§ 5. Асноўныя законы хіміі. Закон пастаянства саставу рэчыва. Закон захавання масы рэчыва
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 5. Асноўныя законы хіміі. Закон пастаянства саставу рэчыва. Закон захавання масы рэчыва |
| Напечатано:: | Гость |
| Дата: | Вторник, 15 Июль 2025, 14:51 |
Фундаментальныя законы хіміі дазваляюць апісваць якасны і колькасны састаў рэчываў, а таксама змены саставу падчас хімічных ператварэнняў. Без ведання гэтых законаў немагчымыя хімічны аналіз саставу рэчыва, вылічэнне колькасцей рэагентаў для правядзення хімічных рэакцый у прамысловасці і ў лабараторыі, вызначэнне выхаду прадуктаў.
Закон пастаянства саставу рэчыва
Закон пастаянства саставу рэчыва ўстаноўлены французскім вучоным Ж. Прустам у 1801 годзе.
У сучаснай фармулёўцы закон гучыць так: усялякае хімічна чыстае рэчыва малекулярнай будовы незалежна ад спосабу атрымання мае пастаянны састаў, гэта значыць складаецца з адных і тых жа хімічных элементаў, атамы якіх знаходзяцца ў пастаянных для дадзенага рэчыва колькасных суадносінах.
Закон Пруста ўказвае на тое, што састаў індывідуальнага чыстага рэчыва можа быць апісаны пэўнай хімічнай формулай. Напрыклад, якім бы спосабам ні атрымлівалі вуглякіслы газ (спальваннем вугалю, дзеяннем кіслаты на мармур, акісленнем метану), масавая доля вугляроду ў ім складае 27,27 %, кіслароду — 72,73 %; масы вугляроду і кіслароду суадносяцца як: . Такім чынам, у рэчыве на адзін атам вугляроду прыходзіцца два атамы кіслароду, гэта значыць хімічная формула CO2.
Пакажам, як вызначыць формулу рэчыва ў больш складаных выпадках (прыклад 1).
Прыклад 1. У выніку аналізу арганічнага рэчыва вызначылі, што масавыя долі вугляроду, вадароду і кіслароду ў ім адпаведна роўныя 44,78 %, 7,46 % і 47,76 %. Вызначце формулу рэчыва.
Дадзена:
ω(С) = 44,78 %
ω(Н) = 7,46 %
ω(О) = 47,76 %
СxНyOz — ?
Рашэнне
Няхай маса порцыі дадзенага рэчыва роўная 100 г, тады масы элементаў будуць роўныя:
m(С) = 44,78 г; m(Н) = 7,46 г;
m(O) = 47,76 г, и их количества:
Індэксы ў хімічнай формуле паказваюць суадносіны як асобных атамаў, так і іх колькасцей. Знойдзем суадносіны колькасцей атамаў:
х : у : z = n(С) : n(Н) : n(O) = 3,73 моль : 7,46 моль : 2,99 моль = 3,73 : 7,46 : 2,99.
Вызначым індэксы x, y и z. Для гэтага кожны са знойдзеных лікаў падзелім на найменшы з іх, гэта значыць на 2,99, а потым памножым на 4 для атрымання цэлалікавых значэнняў:
x : y : z = 1,25 : 2,5 : 1 = 5 : 10 : 4.
Такім чынам, найпрасцейшая формула рэчыва С5Н10O4.
Адказ: С5Н10O4.
Такім чынам, веданне масавых долей элементаў у рэчыве або іх мас у пэўнай порцыі рэчыва дазваляе вызначыць формулу рэчыва.
У выпадку некаторых рэчываў немалекулярнай будовы закон пастаянства саставу справядлівы толькі прыблізна. Іх састаў можа вар’іравацца ў вызначаных межах у залежнасці ад умоў сінтэзу або апрацоўкі рэчыва.
Для рэчываў немалекулярнай будовы існуюць адхіленні ад закону, якія не маглі быць выяўлены ў XVII–XIX стагоддзях з-за адсутнасці дакладных метадаў аналізу. Так, аксід жалеза(II) мае састаў у інтэрвале Fe0,89O—Fe0,95O, аксід тытану(III) — Ti2O2,6—Ti2O3,4. Адна з прычын парушэння саставу крыецца ў дэфектах, якія ўзнікаюць пры фарміраванні крышталёў немалекулярных рэчываў. Такія злучэнні атрымалі назву нястэхіяметрычных, або берталідаў, у гонар французскага хіміка К. Бертале. У выпадку вельмі малых адхіленняў ад пастаянства саставу суадносіны атамаў у злучэннях практычна цэлалікавыя, а самі злучэнні адносяць да стэхіяметрычных і называюць дальтанідамі ў гонар Дж. Дальтана — аднаго з заснавальнікаў атамна-малекулярнага вучэння (напрыклад, хларыд калію, аксід кальцыю).
Закон захавання масы рэчыва
Закон захавання масы рэчыва дазваляе вылічваць масы рэчываў, якія ўступаюць у рэакцыю або якія ўтвараюцца ў выніку яе працякання.
Нагадаем, што працэс ператварэння адных рэчываў у іншыя без змены агульнай колькасці і прыроды атамаў, з якіх гэтыя рэчывы складаюцца, называюць хімічнай рэакцыяй. Рэчывы, што ўступаюць у хімічную рэакцыю, — гэта рэагенты, а што ўтвараюцца ў выніку хімічнай рэакцыі — гэта прадукты.
Працяканне хімічных рэакцый падпарадкоўваецца закону захавання масы рэчываў: маса рэчываў, якія ўступілі ў хімічную рэакцыю, роўная масе рэчываў, якія ўтварыліся.
Дзеянне закону можна паказаць на наступным прыкладзе. Калі закрытую колбу з невялікай колькасцю фосфару ўзважыць, а потым нагрэць, то фосфар загараецца яркім полымем, а колба напаўняецца белым дымам. Паўторнае ўзважванне паказвае, што агульная маса колбы са змесцівам не змянілася (мал. 10).
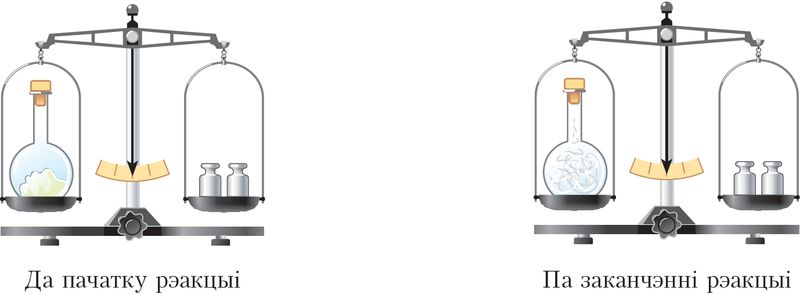
З пазіцыі атамна-малекулярнага вучэння закон можна растлумачыць тым, што пры хімічных рэакцыях атамы не знікаюць і не ўзнікаюць зноў, іх агульны лік застаецца нязменным, а значыць, і сумарныя масы рэчываў да і пасля рэакцыі аднолькавыя.
Вялікі ўклад у эксперыментальны доказ закону захавання масы рэчыва ўнеслі доследы рускага вучонага М. В. Ламаносава і французскага хіміка А. Лавуазье (2-я палова XVIII ст.) па вымярэнні масы зыходных рэчываў і масы прадуктаў, якія з іх атрымліваюцца.
Пакажам, як можна выкарыстоўваць закон захавання масы рэчыва для колькасных разлікаў па ўраўненнях рэакцый на прыкладзе гарэння метану ў кіслародзе з утварэннем вады і вуглякіслага газу.
Схема гэтай рэакцыі:
Перад формуламі паставім каэфіцыенты, якія павінны ўраўнаваць лік атамаў рэагентаў і прадуктаў:
Гэта ўраўненне сведчыць пра тое, што ўтварэнне адной малекулы вуглякіслага газу і дзвюх малекул вады адбываецца, калі адна малекула метану прарэагуе з дзвюма малекуламі кіслароду. Каэфіцыенты паказваюць, у якіх мольных суадносінах рэагуюць рэчывы і ўтвараюцца прадукты.
Так, са складзенага ўраўнення рэакцыі відаць, што калі ў рэакцыю ўступае 1 моль метану, то на яго спальванне выдаткоўваецца 2 моль кіслароду, у выніку ўтвараюцца 2 моль вады і 1 моль вуглякіслага газу.
З улікам гэтых колькасных суадносін можна разлічыць масу (колькасць, аб’ём) рэагентаў, неабходных для атрымання пэўнай колькасці прадуктаў, і наадварот — прадуктаў па зыходных рэчывах.
Прыклад 2. Вызначце масу сульфату алюмінію, які ўтварыўся пры поўным растварэнні алюмінію масай 13,5 г у разбаўленай сернай кіслаце.
Дадзена:
m(Аl) = 13,5 г
m(Al2(SО4)3) — ?
Рашэнне
M(Al) = 27 г/моль; M(Al2(SO4)3) = 342 г/моль.
Колькасць алюмінію, які ўступіў у хімічную рэакцыю:
З улікам ва ўраўненні рэакцыі каэфіцыентаў маем:
адкуль
, гэта значыць
моль.
Масса соли:
m(Al2(SO4)3) = n(Al2(SO4)3) ∙ M(Al2(SO4)3) = 0,25 моль ∙ 342 г/моль = 85,5 г.
Адказ: m(Al2(SO4)3) = 85,5 г.
Прыклад 3. Пры гарэнні магнію масай 1,2 г утварыўся яго аксід масай 2 г. Вызначце аб’ём кіслароду (н. у.), выдаткаванага на гарэнне магнію.
Рашыць такую задачу можна як з дапамогай ураўнення рэакцыі, так і без яго. Разгледзім другі спосаб.
Дадзена:
m(Mg) = 1,2 г
m(MgO) = 2 г
V(O2) — ?
Рашэнне
СЗгодна з законам захавання масы рэчываў, маса рэчываў, якія ўтварыліся, роўная масе рэчываў, якія ўступілі ў хімічную рэакцыю:
Таму маса кіслароду роўная:
а яго колькасць складае:
Аб’ём кіслароду роўны:
Адказ: V(O2) = 0,56 дм3.
Усялякае хімічна чыстае рэчыва малекулярнай будовы незалежна ад спосабу атрымання мае пастаянны састаў.
Рэчывы немалекулярнай будовы не заўсёды маюць пастаянны састаў.
Маса рэчываў, якія ўступілі ў хімічную рэакцыю, роўная масе рэчываў, якія ўтварыліся.
Пытанні, заданні, задачы
1. Сфармулюйце асноўныя законы хіміі, якія апісваюць якасны і колькасны састаў рэчываў, а таксама змены гэтага саставу падчас хімічных ператварэнняў.
2. У выніку рэакцыі раскладання карбанату кальцыю пры яго гартаванні адбылося памяншэнне масы цвёрдага рэчыва. Што, акрамя масы цвёрдага прадукту, трэба вымераць для пацвярджэння закону захавання масы рэчыва?
3. Як і чаму змяняецца маса порцыі жалезных апілак пры іх захоўванні на паветры?
4. Расстаўце каэфіцыенты ў схемах рэакцый:
- С2Н2 + О2 → СО2 + Н2О;
- Аl2О3 + H2SO4 → Аl2(SO4)3 + H2O;
- Аl + HCl → AlCl3 + H2;
- Fe + Cl2 → FeCl3.
5. На электронныя вагі паставілі дзве шклянкі, якія змяшчаюць пітную соду і саляную кіслату. Потым, зняўшы шклянкі з вагаў, асцярожна перасыпалі парашок соды ў шклянку з кіслатой, пасля чаго абедзве шклянкі зноў паставілі на вагі. Як змяніліся паказанні на табло вагаў?
6. Вызначце масу хларыду жалеза(III), які ўтварыўся пры гарэнні жалеза масай 2,8 г у хлоры.
7. Вызначце аб’ём паветра (н. у.), які неабходны для абпалу пірыту FeS2 масай 1,2 кг. Абпал пірыту на паветры працякае па схеме: FeS2 + О2 → Fe2О3 + SO2↑.
8. Чаму роўная маса солі, атрыманай пры ўзаемадзеянні раствору, які змяшчае 10 г гідраксіду натрыю, з растворам, у якім утрымліваецца 10 г хлоравадароду?
9. Вызначце хімічную формулу рэчыва, у якім:
- а) масавыя долі жалеза і кіслароду адпаведна роўныя 72,4 % і 27,6 %;
- б) суадносіны мас кальцыю, азоту і кіслароду роўныя 10 : 7 : 24;
- в) на 1,83 г аксіду хлору прыходзіцца 0,71 г хлору;
- г) масавыя долі натрыю, серы і кіслароду адпаведна роўныя 0,365, 0,254 і 0,381.
10. Сумесь аксідаў магнію і кальцыю масай 1,04 г растварылі ў азотнай кіслаце. Пры гэтым утварылася сумесь нітратаў масай 3,2 г. Вылічыце масу кожнага з аксідаў.
*Самакантроль
1. Закон захавання масы рэчываў у хімічных рэакцыях выкарыстоўваецца:
- а) пры вылічэнні адноснай малекулярнай масы;
- б) пры расстаноўцы каэфіцыентаў ва ўраўненнях рэакцый;
- в) у разліках па ўраўненнях рэакцый;
- г) пры складанні хімічнай формулы па валентнасці.
2. Правільна расстаўлены каэфіцыенты ва ўраўненнях рэакцый:
- а) Al2O3 + 3H2SO4 = Al2(SO4)3 + 6H2O;
- б) 2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑;
- в) 4FeS2 + 11O2 = 8SO2 + 2Fe2O3;
- г) С4Н10 + 6О2 = 4СО2 + 5Н2О.
3. Назавіце рэчывы, маса якіх павялічваецца пры награванні ў адкрытым сасудзе:
- а) Cu;
- б) Fe;
- в) CаСО3;
- г) Рb.
4. Масавыя долі элементаў у бінарным злучэнні роўныя. Хімічная формула злучэння:
- а) NO;
- б) СО;
- в) SO2;
- г) SO3.
5. Нястэхіяметрычны састаў могуць мець злучэнні:
- а) NH3;
- б) FeО;
- в) NiO;
- г) CO.