§ 4. Колькасныя характарыстыкі рэчыва
Малярная маса
Выкарыстанне адзінкі вымярэння колькасці рэчыва дазваляе ўзважваць рэчыва пэўнымі порцыямі колькасцю 1 моль або некалькі моляў. Маса аднаго моля рэчыва лікава роўная малярнай масе М. Яе таксама можна разлічыць дзяленнем масы порцыі рэчыва m на яго хімічную колькасць (лік моляў):
Такім чынам, малярная маса — велічыня, роўная адносінам масы порцыі рэчыва да яго хімічнай колькасці.
Размернасць малярнай масы — кг/моль, але хімікі часта карыстаюцца дольнай адзінкай г/моль. Лікава малярная маса роўная адноснай малекулярнай (формульнай) масе. Справядлівая толькі колькасная роўнасць, паколькі гаворка ідзе пра розныя фізічныя велічыні. Малярная маса характарызуе порцыю рэчыва, якая змяшчае 6,02 ∙ 1023 часціц, адносная малекулярная маса — адну часціцу (малекулу, формульную адзінку і інш.). Напрыклад, Mr(СО2) = 44, значыць M(СО2) = 44 г/моль. Малярная маса залежыць як ад колькаснага, так і ад якаснага саставу рэчыва (мал. 8).
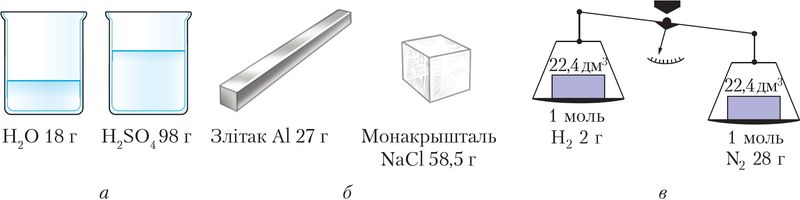
а — вадкіх, б — цвёрдых, в — газападобных (н. у.)
Ведаючы неабходную для хімічнай рэакцыі колькасць рэчыва, лёгка разлічыць яго масу па формуле:
Так, напрыклад, для сінтэзу патрэбен аксід медзі(II) колькасцю 0,25 моль. Паколькі малярная маса M(CuO) = 80 г/моль, то маса яго порцыі складае: m(CuO) = M(CuO) ∙ n(CuO) = 0,25 моль ∙ 80 г/моль = 20 г, гэта значыць эксперыментатар павінен узважыць 20 г аксіду медзі(II).
Акрамя малярнай масы, кожнае рэчыва мае малярны аб’ём Vm, гэта значыць аб’ём рэчыва колькасцю 1 моль.
Малярны аб’ём газу Vm — велічыня, роўная адносінам аб’ёму дадзенай порцыі рэчыва V(Х) да яго хімічнай колькасці n(Х) у гэтай порцыі:
Малярны аб’ём цвёрдых рэчываў і вадкасцей залежыць ад іх шчыльнасці.
Малярны аб’ём вады, кіслаты, металу і солі розны, таму што іх шчыльнасці таксама адрозніваюцца (мал. 8). Малярны аб’ём рэчыва можна таксама разлічыць па вядомай формуле :
дзе ρ — шчыльнасць рэчыва.
Напрыклад, малярны аб’ём воцатнай кіслаты:
Разлічым малярны аб’ём двух адвольна выбраных газаў — азоту і метану (пры нармальных умовах):
Такім чынам, два адвольна выбраныя розныя газападобныя рэчывы — метан і азот — колькасцю 1 моль пры аднолькавых умовах займаюць адзін і той жа аб’ём. Гэта характэрна і для любых іншых газаў. Пры нармальных умовах малярны аб’ём газу Vm = 22,4 дм3/моль.
Нагадаем, што нармальныя ўмовы — гэта тэмпература 0 °С (273 K), ціск — 101,325 кПа.
Роўнасць аб’ёмаў розных газаў колькасцю 1 моль, якія вымяраюцца ў адных і тых жа ўмовах, тлумачыцца аднолькавым лікам малекул у выпадку абодвух газаў і адной і той жа адлегласцю паміж малекуламі. У газах, у адрозненне ад вадкіх і цвёрдых рэчываў, памеры малекул не аказваюць значнага ўплыву на малярны аб’ём.
Сістэматызуем найважнейшыя колькасныя характарыстыкі рэчываў і іх сумесей (табл. 3).
Табліца 3. Колькасныя характарыстыкі рэчыва, порцыі рэчыва і рэчыва ў сумесі
| Колькасныя характарыстыкі рэчыва | |||||
| Рэчыва | Порцыя рэчыва | ||||
| Велічыня | Абазначэнне і адзінкі вымярэння | Велічыня | Абазначэнне і адзінкі вымярэння | ||
| Адносная малекулярная (формульная) маса | Mr | — | Маса | m | кг, г |
| Малярная маса | M | г/моль | Аб’ём | V | м3 |
| Малярны аб’ём | Vm | дм3/моль | Колькасць рэчыва | n | моль |
| Шчыльнасць | ρ | кг/м3 | Лік структурных адзінак (часціц) | N | — |
| Масавая доля элемента | ω | —; % | |||
| Рэчыва ў сумесі | |||||
| Масавая доля рэчыва | ω | —; % | Малярная канцэнтрацыя рэчыва | с | моль/дм3 |
| Аб’ёмная доля рэчыва | φ | —; % | |||