§ 4. Колькасныя характарыстыкі рэчыва
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Падручнік: | § 4. Колькасныя характарыстыкі рэчыва |
| Надрукаваны: | Госць |
| Дата: | Нядзеля 17 Жнівень 2025 |
Навука пачынаецца з тых часоў, як пачынаюць вымяраць.
Дакладная навука немагчымая без меры.
Д. І. Мендзялееў
Уласцівасці рэчываў, якія можна ацаніць колькасна, з дапамогай лічбаў, называюцца фізічнымі велічынямі.
Велічыні, якія характарызуюць масу часціц рэчыва (Аr, Мr, ma) або ўтрыманне рэчыва ў сумесі (масавая доля ω(р-ва), аб’ёмная доля φ(р-ва)), мы разгледзелі ў папярэдніх параграфах. Некаторыя велічыні (аб’ём V, шчыльнасць ρ, маса m) падрабязна вывучаліся ў курсе фізікі.
У дадзеным параграфе больш дэталёва разгледзім асаблівасці адной з сямі асноўных фізічных велічынь Міжнароднай сістэмы адзінак СІ — колькасць рэчыва, таксама вядомай вам па папярэдніх гадах вывучэння хіміі і фізікі.
Колькасць рэчыва (хімічная колькасць)
Рэчывы ўдзельнічаюць у хімічных рэакцыях у пэўных колькасных суадносінах.
Каб вызначыць узаемасувязь колькасці часціц, якія ўзаемадзейнічаюць, з масай і аб’ёмам, увялі фізічную велічыню — колькасць рэчыва.
Колькасць рэчыва (хімічная колькасць) — гэта фізічная велічыня, роўная адносінам колькасці структурных адзінак, якія складаюць яго порцыю, да пастаяннай Авагадра.
Умоўнае абазначэнне колькасці рэчыва — n, адзінка велічыні — 1 моль. Колькасць рэчыва характарызуе лік любых канкрэтных часціц (атамаў, малекул, іонаў, формульных адзінак) у дадзенай порцыі.
Моль — гэта адзінка колькасці рэчыва (хімічнай колькасці).
1 моль — колькасць рэчыва, якая ўтрымлівае 6,02 ∙ 1023 структурных адзінак рэчыва (атамаў, малекул, іонаў або формульных адзінак).
NА = 6,02 · 1023 моль–1 — гэта фундаментальная фізічная канстанта, названая «пастаянная Авагадра». Менавіта столькі атамаў змяшчаецца ў порцыі вугляроду-12 масай 12 г. Столькі ж формульных адзінак знаходзіцца, напрыклад, у порцыі аксіду крэмнію(IV) масай 60 г, лікава роўнай яго адноснай формульнай масе.
Колькасць рэчыва ў нейкай порцыі можна разлічыць дзяленнем ліку ўсіх часціц на лік часціц, якія ўтрымліваюцца ў 1 моль рэчыва:
Такім чынам, уводзячы адзінку вымярэння 1 моль, пераходзім ад разгляду ўзаемадзеяння асобных часціц да разгляду ўзаемадзеяння порцый рэчываў.
Малярная маса
Выкарыстанне адзінкі вымярэння колькасці рэчыва дазваляе ўзважваць рэчыва пэўнымі порцыямі колькасцю 1 моль або некалькі моляў. Маса аднаго моля рэчыва лікава роўная малярнай масе М. Яе таксама можна разлічыць дзяленнем масы порцыі рэчыва m на яго хімічную колькасць (лік моляў):
Такім чынам, малярная маса — велічыня, роўная адносінам масы порцыі рэчыва да яго хімічнай колькасці.
Размернасць малярнай масы — кг/моль, але хімікі часта карыстаюцца дольнай адзінкай г/моль. Лікава малярная маса роўная адноснай малекулярнай (формульнай) масе. Справядлівая толькі колькасная роўнасць, паколькі гаворка ідзе пра розныя фізічныя велічыні. Малярная маса характарызуе порцыю рэчыва, якая змяшчае 6,02 ∙ 1023 часціц, адносная малекулярная маса — адну часціцу (малекулу, формульную адзінку і інш.). Напрыклад, Mr(СО2) = 44, значыць M(СО2) = 44 г/моль. Малярная маса залежыць як ад колькаснага, так і ад якаснага саставу рэчыва (мал. 8).
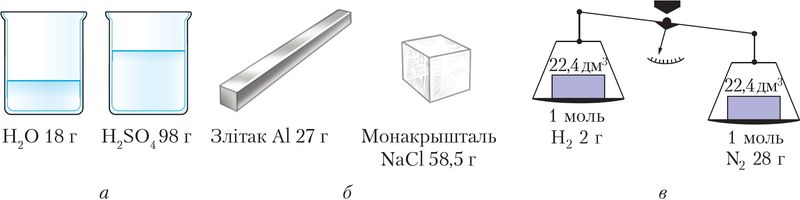
а — вадкіх, б — цвёрдых, в — газападобных (н. у.)
Ведаючы неабходную для хімічнай рэакцыі колькасць рэчыва, лёгка разлічыць яго масу па формуле:
Так, напрыклад, для сінтэзу патрэбен аксід медзі(II) колькасцю 0,25 моль. Паколькі малярная маса M(CuO) = 80 г/моль, то маса яго порцыі складае: m(CuO) = M(CuO) ∙ n(CuO) = 0,25 моль ∙ 80 г/моль = 20 г, гэта значыць эксперыментатар павінен узважыць 20 г аксіду медзі(II).
Акрамя малярнай масы, кожнае рэчыва мае малярны аб’ём Vm, гэта значыць аб’ём рэчыва колькасцю 1 моль.
Малярны аб’ём газу Vm — велічыня, роўная адносінам аб’ёму дадзенай порцыі рэчыва V(Х) да яго хімічнай колькасці n(Х) у гэтай порцыі:
Малярны аб’ём цвёрдых рэчываў і вадкасцей залежыць ад іх шчыльнасці.
Малярны аб’ём вады, кіслаты, металу і солі розны, таму што іх шчыльнасці таксама адрозніваюцца (мал. 8). Малярны аб’ём рэчыва можна таксама разлічыць па вядомай формуле :
дзе ρ — шчыльнасць рэчыва.
Напрыклад, малярны аб’ём воцатнай кіслаты:
Разлічым малярны аб’ём двух адвольна выбраных газаў — азоту і метану (пры нармальных умовах):
Такім чынам, два адвольна выбраныя розныя газападобныя рэчывы — метан і азот — колькасцю 1 моль пры аднолькавых умовах займаюць адзін і той жа аб’ём. Гэта характэрна і для любых іншых газаў. Пры нармальных умовах малярны аб’ём газу Vm = 22,4 дм3/моль.
Нагадаем, што нармальныя ўмовы — гэта тэмпература 0 °С (273 K), ціск — 101,325 кПа.
Роўнасць аб’ёмаў розных газаў колькасцю 1 моль, якія вымяраюцца ў адных і тых жа ўмовах, тлумачыцца аднолькавым лікам малекул у выпадку абодвух газаў і адной і той жа адлегласцю паміж малекуламі. У газах, у адрозненне ад вадкіх і цвёрдых рэчываў, памеры малекул не аказваюць значнага ўплыву на малярны аб’ём.
Сістэматызуем найважнейшыя колькасныя характарыстыкі рэчываў і іх сумесей (табл. 3).
Табліца 3. Колькасныя характарыстыкі рэчыва, порцыі рэчыва і рэчыва ў сумесі
| Колькасныя характарыстыкі рэчыва | |||||
| Рэчыва | Порцыя рэчыва | ||||
| Велічыня | Абазначэнне і адзінкі вымярэння | Велічыня | Абазначэнне і адзінкі вымярэння | ||
| Адносная малекулярная (формульная) маса | Mr | — | Маса | m | кг, г |
| Малярная маса | M | г/моль | Аб’ём | V | м3 |
| Малярны аб’ём | Vm | дм3/моль | Колькасць рэчыва | n | моль |
| Шчыльнасць | ρ | кг/м3 | Лік структурных адзінак (часціц) | N | — |
| Масавая доля элемента | ω | —; % | |||
| Рэчыва ў сумесі | |||||
| Масавая доля рэчыва | ω | —; % | Малярная канцэнтрацыя рэчыва | с | моль/дм3 |
| Аб’ёмная доля рэчыва | φ | —; % | |||
Колькасць рэчыва (хімічная колькасць) — гэта фізічная велічыня, роўная адносінам колькасці структурных адзінак, якія складаюць яго порцыю, да пастаяннай Авагадра.
Колькасць рэчыва можа быць разлічана па адной з трох формул:
Пытанні, заданні, задачы
1. Назавіце фізічныя велічыні, якія абазначаюцца сімваламі: N, NA, V, Vm,
2. Запішыце назвы фізічных велічынь, для вымярэння якіх прызначана лабараторнае абсталяванне, прадстаўленае на малюнку 9.
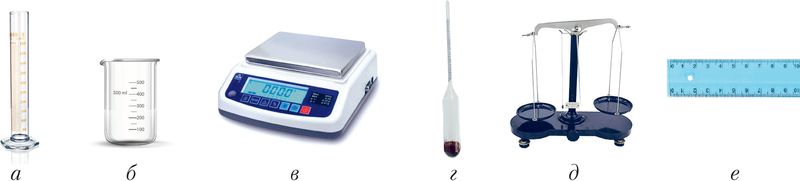
а — мерны цыліндр, б — мерная шклянка, в — вагі электронныя, г — арэометр, д — шалі, е — лінейка
3. Разлічыце колькасць вуглякіслага газу (моль), якая змяшчае 1,505 · 1023 малекул.
4. Вызначце, які аб’ём (н. у.) займае метан:
- а) колькасцю 1,5 моль;
- б) масай 24 кг.
5. Разлічыце адносную малекулярную (формульную) масу, малярную масу, лік структурных адзінак і аб’ём порцыі рэчыва масай 15 г, калі рэчывам з’яўляецца:
- а) воцатная кіслата (ρ(СН3СООН) = 1,05 г/см3);
- б) алюміній (ρ(Al) = 2,7 г/см3);
- в) кісларод (н. у.);
- г) хлор (н. у.).
6. Разлічыце масу малекул О2 і Н2О ў а. а м., грамах, кілаграмах.
7. Вызначце масу сумесі, якая складаецца з 12 моль вадароду і 8 моль азоту.
8. Вызначце лік усіх атамаў у аксідзе крэмнію(IV) масай 3 г.
9. Разлічыце масу воцатнай кіслаты, якая змяшчае столькі ж атамаў, колькі іх знаходзіцца ў вуглякіслым газе масай 704 г?
10. Вызначце масавую долю вугляроду ў сумесі, якая складаецца з 3 моль вуглякіслага і 5 моль чаднага газу.
*Самакантроль
1. Да колькасных характарыстык рэчыва адносяць велічыні, якія пазначаюцца сімваламі:
- а) N;
- б) Vm;
- в) М;
- г) Mr.
2. Аб’ём вадкасці ў лабараторыі вызначаюць з дапамогай:


3. Маса і аб’ём (н. у.) порцыі кіслароду колькасцю 0,2 моль роўныя:
- а) 3,2 г;
- б) 6,4 г;
- в) 112 дм3;
- г) 4,48 дм3.
4. Колькасць звадкаванага азоту масай 1,4 г роўная:
- а) 39,2 моль;
- б) 19,6 моль;
- в) 0,1 моль;
- г) 0,05 моль.
5. Маса сумесі, якая ўтрымлівае кісларод О2 і азон О3 колькасцю 2 моль і 0,1 моль адпаведна, роўная:
- а) 168 г;
- б) 99,2 г;
- в) 68,8 г;
- г) 11,2 г.