§ 3.4. Солі
Класіфікацыя і наменклатура
У залежнасці ад паўнаты замяшчэння атамаў вадароду ў кіслотах або гідраксагруп у саставе асноў адрозніваюць сярэднія, кіслыя і асноўныя солі. Кіслыя солі могуць утвараць толькі шматасноўныя кіслоты (Н2SO4, Н2СO3, Н2S, Н3РO4), асноўныя солі — толькі шматкіслотныя асновы: Mg(OH)2, Cu(OH)2, Al(OH)3.
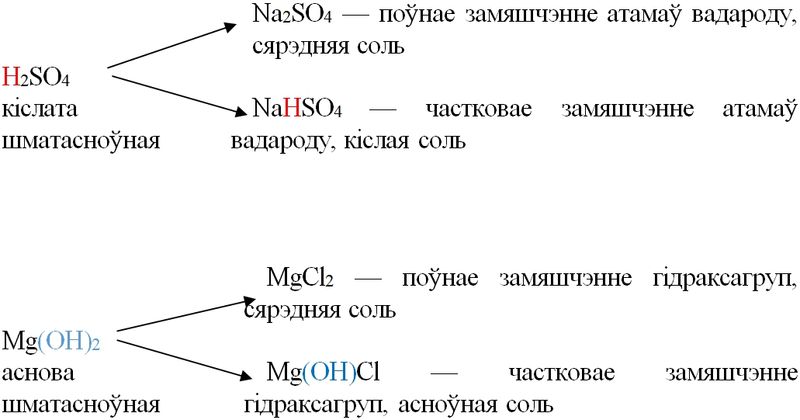
У аснове сістэматычных назваў солей ляжаць назвы кіслотных астаткаў: MgSO4 — сульфат магнію, Fe2(SO4)3 — сульфат жалеза(III). У назвы асноўных солей перад назвай металу дадаюць слова «гідракса-»: Mg(OH)Cl — хларыд гідраксамагнію, (СuOH)2CO3 — карбанат гідраксамедзі(II) (малахіт). Кіслыя солі называюць, дадаючы перад назвай кіслотнага астатку слова «гідра-»: NaHCO3 — гідракарбанат натрыю (пітная сода).
Цвёрдыя солі часта ў сваім саставе ўтрымліваюць ваду, і ў гэтым выпадку іх называюць крышталегідратамі: FeSO4 ∙ 7H2O, Na2СO3 ∙ 10H2O. У іх назвах указваюць лік малекул вады, якія прыходзяцца на адну формульную адзінку бязводнай солі: CuSO4 ∙ 5H2O — пентагідрат сульфату медзі(II), Na2SO4 ∙ 10H2O — дэкагідрат сульфату натрыю. Іх трывіяльныя назвы — медны купарвас, мірабіліт (глаўберава соль).
Асобную групу солей утвараюць комплексныя злучэнні. У школьным курсе вы сустрэнеце невялікую колькасць такіх злучэнняў, якія ўтрымліваюць складаныя, комплексныя, іоны. Найбольш часта ў састаў комплекснага іона ўваходзяць катыён металу і звязаныя з ім аніёны або малекулы. Пры напісанні хімічных формул такія іоны змяшчаюць у квадратныя дужкі. Гэтым падкрэсліваюць асабліва моцныя сувязі паміж атамамі ў комплексным іоне. Прыкладамі могуць служыць:
- Na2[Zn(OH)4] — тэтрагідроксацынкат натрыю;
- K3[Al(OH)6] — гексагідроксаалюмінат калію;
- K[Al(OH)4] — тэтрагідроксаалюмінат калію.
У курсе арганічнай хіміі вы пазнаёміліся з солямі карбонавых кіслот — ацэтат натрыю СН3СООNa, стэарат калію C17H35COOK (вадкае мыла) — і солямі амінаў — хларыд метыламонію СН3NH3Cl, гідрасульфат феніламонію С6Н5NH3HSO4.