§ 3.4. Солі
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 3.4. Солі |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 17 Август 2025, 00:38 |
Солі — гэта складаныя рэчывы, якія складаюцца з атамаў металаў і кіслотных астаткаў.
З пазіцый тэорыі электралітычнай дысацыяцыі солямі называюць складаныя рэчывы, пры дысацыяцыі якiх утвараюцца катыёны металаў і аніёны кіслотных астаткаў. Да солей таксама адносяць неарганічныя злучэнні, якія змяшчаюць іон амонію і кіслотны астатак: NH4Cl, (NH4)2SO4.
Класіфікацыя і наменклатура
У залежнасці ад паўнаты замяшчэння атамаў вадароду ў кіслотах або гідраксагруп у саставе асноў адрозніваюць сярэднія, кіслыя і асноўныя солі. Кіслыя солі могуць утвараць толькі шматасноўныя кіслоты (Н2SO4, Н2СO3, Н2S, Н3РO4), асноўныя солі — толькі шматкіслотныя асновы: Mg(OH)2, Cu(OH)2, Al(OH)3.
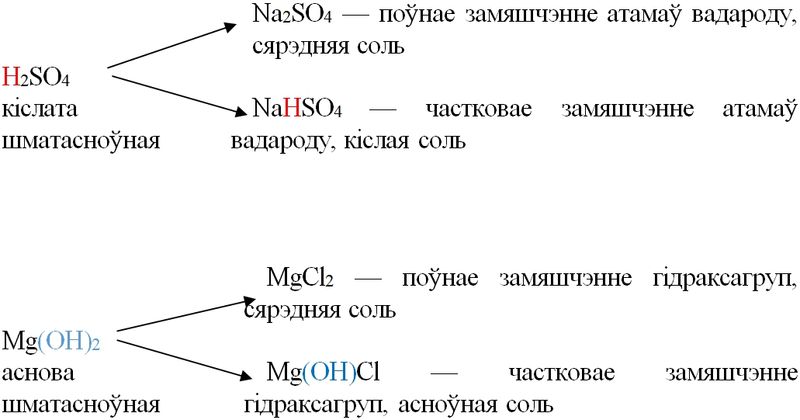
У аснове сістэматычных назваў солей ляжаць назвы кіслотных астаткаў: MgSO4 — сульфат магнію, Fe2(SO4)3 — сульфат жалеза(III). У назвы асноўных солей перад назвай металу дадаюць слова «гідракса-»: Mg(OH)Cl — хларыд гідраксамагнію, (СuOH)2CO3 — карбанат гідраксамедзі(II) (малахіт). Кіслыя солі называюць, дадаючы перад назвай кіслотнага астатку слова «гідра-»: NaHCO3 — гідракарбанат натрыю (пітная сода).
Цвёрдыя солі часта ў сваім саставе ўтрымліваюць ваду, і ў гэтым выпадку іх называюць крышталегідратамі: FeSO4 ∙ 7H2O, Na2СO3 ∙ 10H2O. У іх назвах указваюць лік малекул вады, якія прыходзяцца на адну формульную адзінку бязводнай солі: CuSO4 ∙ 5H2O — пентагідрат сульфату медзі(II), Na2SO4 ∙ 10H2O — дэкагідрат сульфату натрыю. Іх трывіяльныя назвы — медны купарвас, мірабіліт (глаўберава соль).
Асобную групу солей утвараюць комплексныя злучэнні. У школьным курсе вы сустрэнеце невялікую колькасць такіх злучэнняў, якія ўтрымліваюць складаныя, комплексныя, іоны. Найбольш часта ў састаў комплекснага іона ўваходзяць катыён металу і звязаныя з ім аніёны або малекулы. Пры напісанні хімічных формул такія іоны змяшчаюць у квадратныя дужкі. Гэтым падкрэсліваюць асабліва моцныя сувязі паміж атамамі ў комплексным іоне. Прыкладамі могуць служыць:
- Na2[Zn(OH)4] — тэтрагідроксацынкат натрыю;
- K3[Al(OH)6] — гексагідроксаалюмінат калію;
- K[Al(OH)4] — тэтрагідроксаалюмінат калію.
У курсе арганічнай хіміі вы пазнаёміліся з солямі карбонавых кіслот — ацэтат натрыю СН3СООNa, стэарат калію C17H35COOK (вадкае мыла) — і солямі амінаў — хларыд метыламонію СН3NH3Cl, гідрасульфат феніламонію С6Н5NH3HSO4.
Фізічныя ўласцівасці
Солі — цвёрдыя крышталічныя рэчывы. Афарбоўка солей можа быць абумоўлена як іонамі металу, так і аніёнамі кіслотнага астатку (мал. 6.4).

У залежнасці ад саставу солі маюць розную растваральнасць у вадзе. Самыя простыя звесткі пра яе прыведзены ў «Табліцы растваральнасці солей, кіслот, асноў» (гл. форзац падручніка).
У водным растворы пры дысацыяцыі cолей утвараюцца катыёны металу і аніёны кіслотнага астатку:
Na2SO4 → 2Na+ + (сярэдняя соль);
NaHCO3 → Na+ + (кіслая соль слабай кіслаты);
NaHSO4 → Na+ + H+ + (кіслая соль моцнай кіслаты);
Na2[Zn(OH)4] → 2Na+ + [Zn(OH)4]2− (комплексная соль).
Хімічныя ўласцівасці солей
Да агульных хімічных уласцівасцей солей адносяць іх узаемадзеянне з кіслотамі, шчолачамі, іншымі солямі і металамі.
| Рэагент і ўраўненне рэакцыі | Асаблівасці рэакцыі |
|---|---|
| 1. Кіслата: Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O |
Больш моцная кіслата выцясняе больш слабую з яе солі |
| 2. Шчолач: CuCl2 + 2KOH = Cu(OH)2↓ + 2KCl |
Утвараецца нерастваральная аснова і новая соль (моцныя асновы выцясняюць слабыя) |
| 3. Соль: BaCl2 + K2SO4 = BaSO4↓ + 2KCl |
Утвараюцца дзве новыя солі, адна з якіх нерастваральная |
| 4. Метал: CuSO4 + Fe = FeSO4 + Cu↓ |
Больш актыўны метал выцясняе менш актыўны з раствору яго солі |
| 5. Неметал: Na2S + Cl2 = 2NaCl + S↓ |
Больш актыўны неметал выцясняе менш актыўны з раствору яго солі |
| 6. Кіслотны (амфатэрны) аксід: Na2CO3 + SiO2 |
Пры сплаўленні ўтвараецца новая соль і лятучы аксід |
| 7. Тэрмічнае раскладанне: CaCO3 2Cu(NO3)2 |
Пры награванні раскладаюцца, у асноўным, карбанаты і нітраты |
Рэакцыі раствораў солей з металамі маюць і іншыя асаблівасці, акрамя адзначаных вышэй. Сапраўды, больш актыўныя металы выцясняюць менш актыўныя. Але калі больш актыўным з’яўляецца шчолачны або шчолачназямельны метал (Са, Sr, Ba, Ra), то ў растворы ён у першую чаргу рэагуе з вадой, а ўтвораная шчолач можа ўступіць у рэакцыю з соллю. Напрыклад, пры апусканні кавалачка натрыю ў раствор сульфату медзі(II) магчымыя такія рэакцыі:
2Na + 2H2O = 2NaOH + H2↑,
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4,
гэта значыць, адбываецца рэакцыя абмену паміж соллю і ўтворанай шчолаччу.
З прычыны вылучэння значнай колькасці цеплаты ўтвораны гідраксід раскладаецца да аксіду, вадарод часткова аднаўляе аксід:
Cu(OH)2 CuO + 2H2O;
CuO + H2 Cu + H2O.
Дадаткова можна адзначыць рэакцыі солей бескіслародных кіслот з неметаламі, кіслародзмяшчальных кіслот — з кіслотнымі і амфатэрнымі аксідамі, а таксама тэрмічнае раскладанне некаторых солей.
У раздзеле IV вы разгледзіце яшчэ адну важную ўласцівасць многіх солей — здольнасць падвяргацца гідролізу.
Атрыманне солей
Спосабы атрымання солей шматлікія і разнастайныя, пры гэтым яны з’яўляюцца адлюстраваннем хімічных уласцівасцей аксідаў, кіслот, асноў. Напрыклад, некаторыя найважнейшыя спосабы можна паказаць як узаемадзеянне рэчываў розных класаў. Гэта наглядна ілюструюць прыведзеныя ніжэй ураўненні рэакцый.
Пытанні, заданні, задачы
1. Выпішыце формулы солей: NaOH, Na2SO4, Na2O, Cu(OH)2, CuCl2, Cu(NO3)2.
2. Запішыце формулы солей: Mg(OH)NO3, (CuOH)2CO3, NaHCO3, KH2PO4, (NH4)2HPO4. Падкрэсліце формулы кіслых солей.
3. Назавіце солі: FeCl2, MgSO4, CaCO3, NaHCO3, Mg(OH)Cl, NaH2PO4.
4. Складзіце формулы солей:
- а) фасфат калію, карбанат магнію, сілікат натрыю, сульфат жалеза(III);
- б) фасфат цынку, сульфат алюмінію, нітрат медзі(II), хларыд кальцыю.
5. Складзіце ўраўненні магчымых рэакцый раствору нітрату жалеза(II) з рэчывамі, формулы якіх: Cu, Na, NaOH, Na2SO4, KNO3, HCl.
6. У кожным радзе ўкажыце метал, здольны ўступаць у рэакцыю замяшчэння з водным растворам солі CuCl2:
- а) Na, Fe, Hg;
- б) Ca, Zn, Ag.
Складзіце ўраўненні адпаведных рэакцый.
7. Вызначце масавую долю солі ў растворы, атрыманым пры растварэнні меднага купарвасу масай 25 г:
- а) у вадзе масай 275 г;
- б) у растворы сульфату медзі(II) масай 195 г з масавай доляй солі 5 %.
8. Вызначце малярную канцэнтрацыю нітрату натрыю ў растворы:
- а) з масавай доляй 18 % і шчыльнасцю 1,118 г/см3;
- б) з масавай доляй 1 % і шчыльнасцю 1,004 г/см3.
9. Прапануйце пяць спосабаў атрымання солі:
- а) Ca3(PO4)2;
- б) ZnSO4.
10. Пасля награвання нітрату медзі(II) масай 9,4 г маса цвёрдага астатку склала 5,08 г. Вызначце масу нераскладзенага нітрату.
Самакантроль
1. Да солей адносяць рэчывы, формулы якіх:
- а) СаSO4;
- б) Mg(OH)Cl;
- в) С6Н5ОK;
- г) KH2PO4.
2. Пры ўмераным награванні раскладаюцца солі металаў:
- а) сульфаты;
- б) фасфаты;
- в) хларыды;
- г) карбанаты.
3. Хларыд жалеза(II) можа рэагаваць з:
- а) Zn;
- б) Сu(OH)2;
- в) NaОH;
- г) Pb(NO3)2.
4. Соль не ўтворыцца ў рэакцыі:
- а) Fe + HCl →;
- б) Mg(OH)2 + HNO3 →;
- в) Fe + H2O →;
- г) K3PO4 + AgNO3 →.
5. Для прыгатавання раствору аб’ёмам 0,5 дм3 сульфату медзі(II) з малярнай канцэнтрацыяй 0,01 моль/дм3 неабходна ўзважыць медны купарвас масай:
- а) 0,8 г;
- б) 1,25 г;
- в) 1,6 г;
- г) 2,5 г.
Падрыхтуйце паведамленне. Аксіды і солі ў ювелірным магазіне.