§ 30. Галогены
*Получение хлора в лаборатории и промышленности
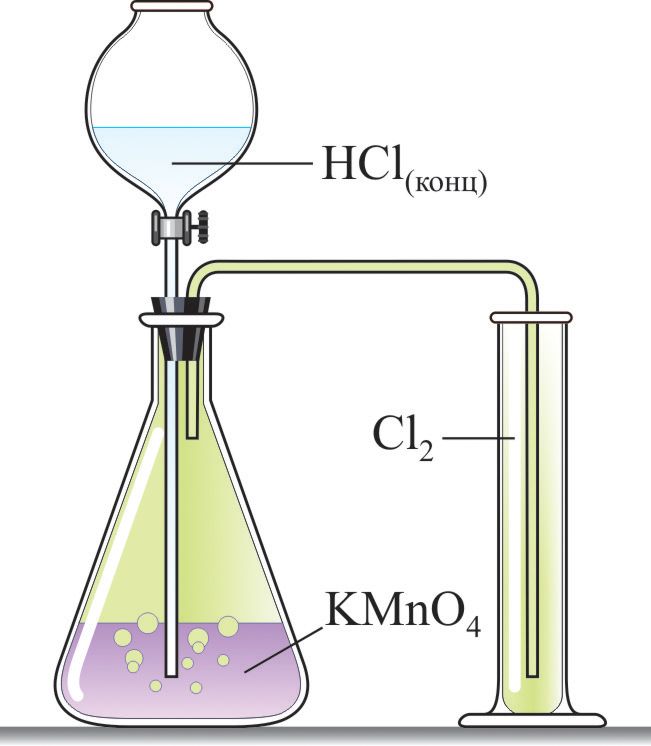
Для получения хлора в лаборатории используют реакцию концентрированной соляной кислоты с сильными окислителями (МnO2, KМnO4, KClO3) (рис. 69.1):
;
.
Чтобы удалить следовые количества хлороводорода, полученный газ пропускают через воду, а для удаления паров воды — через концентрированную серную кислоту .
Впервые хлор получил шведский химик Карл Вильгельм Шееле (1742–1786) при взаимодействии минерала пиролюзита (оксида марганца(IV)) и соляной кислоты в 1774 году. Ему принадлежит честь открытия множества неорганических и органических веществ.
В промышленности хлор получают в основном электролизом водного раствора хлорида натрия. При этом на аноде выделяется хлор, а на катоде — водород.
Хлор также образуется при электролизе расплава хлорида натрия:
2NaCl(расплав) 2Na + Cl2↑.
Подробнее процессы электролиза вы рассмотрите в главе «Металлы».