§ 30. Галогены
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 30. Галогены |
| Напечатано:: | Гость |
| Дата: | Friday, 12 September 2025, 21:22 |

Галогены как химические элементы
К галогенам относят пять элементов VIIА-группы периодической системы: фтор F, хлор Сl, бром Вr, йод I и астат At.
Атомы галогенов содержат по 7 электронов на внешнем электронном слое, общая электронная конфигурация которого ns2np5, то есть галогены являются р-элементами (Приложение 1). Электронно-графические схемы внешнего электронного слоя атомов фтора и хлора выглядят следующим образом:
При этом на внешнем электронном слое у атома фтора четыре орбитали, а атомы остальных галогенов содержат ещё пять незаполненных d-орбиталей.
Фтор как самый электроотрицательный элемент в соединениях проявляет только отрицательную степень окисления –1. Характерные для других элементов степени окисления (–1, +1, +3, +5, +7) можно объяснить возможностью распаривания электронов внешнего электронного слоя. В случае атомов хлора это выглядит так:
Степени окисления +1, –1, 0
Степень окисления +5
Степень окисления +3
Степень окисления +7
Примерами соединений с различными степенями окисления хлора могут служить известные вам вещества: (галит),
(бертолетова соль),
(хлорная кислота).
В природе галогены существуют в виде соединений с другими элементами (табл. 21, рис. 68). Фтор и хлор принадлежат к двадцати самым распространённым элементам в земной коре.
Таблица 21. Химические элементы галогены
| Элемент | Радиус атома, нм | χ | Степени окисления | Природные соединения |
| Фтор 9F | 0,071 | 4,0 | –1, 0 | CaF2 (флюорит, плавиковый шпат); Na3[AlF6] (криолит); Са5[РО4]3F (фторапатит) |
| Хлор 17Cl | 0,099 | 3,0 | –1, 0, +1, +3, +5, +7 | NaCl (каменная соль, галит); KCl (сильвин); Смесь NaCl и KCl (сильвинит); KMgCl3 · 6H2O (карналлит) |
| Бром 35Br | 0,114 | 2,8 | –1, 0, +1, +3, +5, +7 | NaBr, KBr, MgBr2 — в отложениях хлоридов; в морской воде в виде бромид-ионов |
| Йод 53I | 0,133 | 2,5 | –1, 0, +1, +3, +5, +7 | KIO3 (йодат калия) — в залежах чилийской селитры, в подземных буровых водах, в морских водорослях |

Галогены как простые вещества
Строение простых веществ. Простые вещества галогены состоят из двухатомных молекул, атомы в которых связаны ковалентной неполярной σ-связью (рис. 69).

В ряду галогенов F2 — Cl2 — Br2 — I2 c увеличением размеров молекул увеличиваются силы межмолекулярного взаимодействия, поэтому в группе с увеличением атомного номера элемента повышаются температуры плавления и кипения простых веществ галогенов. Так, при комнатной температуре фтор и хлор — газы, бром — жидкость, йод — твёрдое вещество (табл. 22).
Таблица 22. Физические свойства галогенов
| Вещество | Фтор F2 | Хлор Cl2 | Бром Вr2 | Йод I2 |
| Масштабные модели молекул | ||||
| Tпл., °С | –220 | ‒101 | ‒7 | +113,5 |
| Tкип., °С | –188 | ‒34 | +58 | +184 |
| Агрегатное состояние при комнатной температуре | Газ | Газ | Жидкость | Твёрдое вещество |
| Цвет | Светло-жёлтый | Жёлто-зелёный | Красно-бурый | Тёмно-серый |
| Запах | Резкий, раздражающий | Резкий, удушливый | Резкий, зловонный | Резкий |
Растворимость в воде хлора, брома и йода умеренная. Их водные растворы, используемые в лабораторной практике, называют хлорной, бромной и йодной водой. Растворимость галогенов значительно выше в неполярных и малополярных органических растворителях — бензоле С6Н6, тетрахлорметане ССl4, этаноле С2Н5ОН.
Химические свойства

алюминия
с йодом
1. Реакции с металлами. Наиболее активным из галогенов является фтор. Уже при комнатной температуре он реагирует с большинством металлов:
Хлор при нагревании реагирует с серебром, золотом, платиной и другими металлами:
Для достижения заметной скорости реакции других галогенов с металлами обычно также требуется предварительное нагревание металла.
Обратим внимание на то, что простые вещества хлор и бром в силу высокой окислительной способности образуют c железом соединения ,
, в то время как действие соляной кислоты на железо приводит к образованию
.
2. Реакции с водородом:
- а) фтор взаимодействует при комнатной температуре:
;
- б) хлор реагирует при поджигании или воздействии ультрафиолетового излучения:
;
- в) бром реагирует при нагревании:
, реакция обратима;
- г) йод вступает в реакцию медленно даже при нагревании, реакция обратима:
.
Таким образом, реакционная способность по отношению к водороду снижается в ряду галогенов F2 — Cl2 — Br2 — I2.
3. Реакции с растворами солей галогеноводородных кислот. В водных растворах галогеноводородных кислот, а также их солей более электроотрицательный галоген вытесняет менее электроотрицательный. Так, хлор вытесняет бром и йод, например:
.
Бром вытесняет только йод из растворов йодидов:
.
Способность более активных галогенов вытеснять менее активные из их соединений используется на практике. Например, бром и йод получают при действии хлора на их соединения.
Для фтора реакция вытеснения из растворов менее активных галогенов не характерна, так как фтор вступает в реакцию с водой.
Фтор с водой реагирует, окисляя атомы кислорода в молекулах воды:
2F2 + 2H2O = 4HF + O2↑.
При растворении хлора в воде протекает обратимая реакция: . Образующийся раствор называют хлорной водой. Аналогично происходит растворение в воде брома и йода, но равновесные концентрации продуктов уменьшаются в ряду Cl2 — Br2 — I2.
4. Реакции с органическими веществами. Галогенирование органических соединений происходит чаще всего в реакциях замещения (насыщенные и ароматические углеводороды) или присоединения (ненасыщенные и ароматические углеводороды). Например:
- • хлорирование метана:
(реакция замещения);
- • бромирование бензола:
;
- • взаимодействие бромной воды с фенолом:
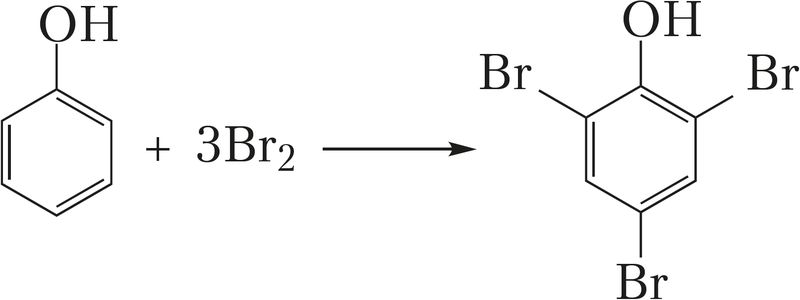 + 3HBr (реакция замещения);
+ 3HBr (реакция замещения);- • хлорирование этилена:
(реакция присоединения).
Из курсов биологии и органической химии вам также известно, что йод взаимодействует с раствором крахмала, образуя соединение синего цвета, а бромную воду используют как реагент на алкены, фенол, анилин.
5. Взаимодействие хлора со щелочами. В зависимости от условий проведения реакции образуются разные продукты. Так, при взаимодействии хлора с холодным раствором щёлочи хлор образует соли хлорид и гипохлорит:
а с горячим раствором — хлорид и хлорат:
Гипохлорит натрия широко применяется для дезинфекции сточных вод, воды в системах водоснабжения и плавательных бассейнов, в пищевой и целлюлозно-бумажной промышленности, медицине.
6. Особенности химических свойств фтора. Фтор, в отличие от других галогенов, которые не взаимодействуют с кислородом, реагирует с ним, однако процесс протекает только под действием электрического разряда при −196 °С:
В этом соединении атомы фтора имеют степень окисления −1, атомы кислорода как менее электроотрицательного элемента имеют положительную степень окисления +1. Поэтому O2F2 называют фторидом кислорода(I).
Вода при соприкосновении со фтором горит. Состав продуктов зависит от условий протекания реакции. Среди продуктов всегда обнаруживают фтороводород и кислород:
.
В атмосфере фтора окисляется даже платина: . Однако некоторые металлы (Mg, Al, Ni, Cu) устойчивы к действию фтора за счёт образования плотной плёнки фторида на поверхности металла.
Под давлением или при действии ультрафиолетового излучения фтор реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Биологическое значение галогенов и их соединений
Соединения галогенов играют значительную роль в жизнедеятельности организмов человека и животных.
Фтор участвует в построении костного скелета и зубной эмали, в процессах обмена веществ в мышцах, железах, нервной ткани. При недостаточном содержании фтора в продуктах питания и питьевой воде происходит поражение зубной эмали. Избыток фтора также оказывает пагубное воздействие: приводит к разрушению зубной эмали и скелета.
Хлор входит в состав соляной кислоты как компонента желудочного сока и обеспечивает переваривание пищи, участвует в обмене веществ. Постоянная концентрация кислоты в желудке поддерживается за счёт поваренной соли, поступающей в организм в составе продуктов питания.
Бром регулирует процессы возбуждения и торможения центральной нервной системы. Именно поэтому при лечении нервных болезней (бессонницы, истерии, неврастении др.) используют бромсодержащие препараты.
Йод играет значительную роль в работе щитовидной железы. Важнейшей функцией вырабатываемых в ней гормонов является регуляция работы мозга и сердца, мускульного возбуждения. Недостаток йода приводит к увеличению щитовидной железы, замедлению умственного и физического развития.
Очень важно с продуктами питания получать достаточное количество каждого микроэлемента, так как их недостаток может стать угрозой здоровью.
Фтор, бром, йод содержатся в следующих продуктах питания.
| F | Листья салата, шпинат, яблоки, грейпфруты, зерновые, рис, картофель, орехи, лук, чай; продукты животного происхождения: морская рыба и морепродукты, курица, яйца, молоко, мясо и субпродукты |
| Br | Бобовые: фасоль, горох, чечевица; орехи, зерновые, морские водоросли |
| I | Морепродукты: морская капуста, рыба; молочные продукты: молоко, сыр, творог; овощи: картофель, морковь, свёкла, лук, помидоры, шпинат, бобовые; фрукты и ягоды: яблоки, сливы, виноград, вишня, земляника; крупы: пшено, гречка |
*Получение хлора в лаборатории и промышленности
Для получения хлора в лаборатории используют реакцию концентрированной соляной кислоты с сильными окислителями (МnO2, KМnO4, KClO3) (рис. 69.1):
;
.
Чтобы удалить следовые количества хлороводорода, полученный газ пропускают через воду, а для удаления паров воды — через концентрированную серную кислоту .
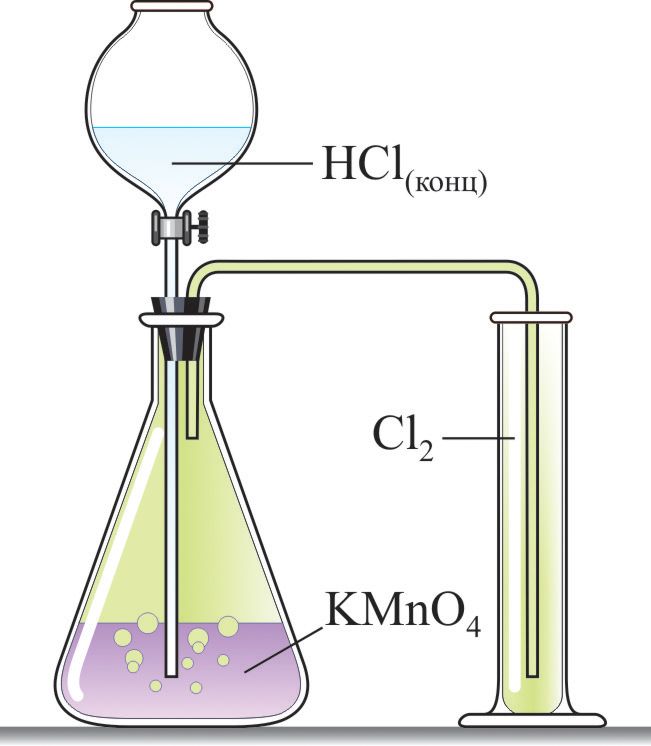
Впервые хлор получил шведский химик Карл Вильгельм Шееле (1742–1786) при взаимодействии минерала пиролюзита (оксида марганца(IV)) и соляной кислоты в 1774 году. Ему принадлежит честь открытия множества неорганических и органических веществ.
В промышленности хлор получают в основном электролизом водного раствора хлорида натрия. При этом на аноде выделяется хлор, а на катоде — водород.
Хлор также образуется при электролизе расплава хлорида натрия:
2NaCl(расплав) 2Na + Cl2↑.
Подробнее процессы электролиза вы рассмотрите в главе «Металлы».
Для атомов фтора характерны степени окисления 0, –1; для хлора, брома и йода — –1, 0, +1, +3, +5, +7.
Галогены являются окислителями в реакциях с металлами и неметаллами, атомы которых имеют меньшую электроотрицательность.
В VIIА-группе окислительные свойства простых веществ галогенов ослабевают при переходе от фтора к йоду.
При галогенировании органических соединений протекают, как правило, реакции замещения либо присоединения.
Вопросы, задания, задачи
1. Укажите:
- а) символы элементов галогенов;
- б) формулы простых веществ галогенов;
- в) биологическую роль каждого из галогенов;
- г) по три продукта питания, содержащих в значительном количестве фтор, бром, йод.
2. Для ряда веществ F2 — Cl2 — Br2 — I2 укажите закономерность изменения:
- а) температуры плавления;
- б) температуры кипения;
- в) активности в реакции с водородом;
- г) активности в реакции с металлами.
Дайте объяснения.
3. Рассчитайте относительную плотность хлора по воздуху.
4. Баллон вмещает 15 кг жидкого хлора. Рассчитайте его количество.
5. Составьте формулы электронных конфигураций атомов фтора и хлора. Укажите сходство и различие в электронном строении этих атомов.
6. Бром массой 4 г растворили в воде объёмом 250 см3. Рассчитайте массовую долю брома в бромной воде.
7. Составьте уравнения реакций:
- а) хлора с железом, натрием, йодидом натрия, этаном;
- б) брома с железом, алюминием, йодидом натрия, бензолом;
- в) бромной воды с йодидом алюминия, этиленом, фенолом, анилином.
8. В баллоне содержится сжиженный хлор массой 50 кг. Определите, какой объём займёт хлор при н. у.
9. Установите химическую формулу соли, в которой массовая доля калия составляет 31,836 %, хлора — 28,980 %, кислорода — 39,184 %. Определите степени окисления атомов.
10. В пронумерованных пробирках находятся растворы фенола, йодида натрия, хлорида калия. Предложите план распознавания веществ с помощью одного реактива. Составьте уравнения соответствующих реакций.
*Самоконтроль
1. Положительные степени окисления не проявляют атомы элемента с конфигурацией внешнего электронного уровня:
- а) 5s25p5;
- б) 4s24p5;
- в) 3s23p5;
- г) 2s22p5.
2. Относительно ряда галогенов F2 — Cl2 — Br2 — I2 справедливыми являются утверждения:
- а) увеличивается длина связи в молекулах простых веществ;
- б) химическая активность повышается;
- в) температура кипения простых веществ возрастает;
- г) возрастает относительная плотность паров вещества по воздуху.
3. Простое вещество хлор реагирует с веществами:
- а) NaBr;
- б) HCl;
- в) КI;
- г) FeCl3.
4. Реакция протекает при пропускании через бромную воду газов:
- а) НCl;
- б) HI;
- в) CН≡СН;
- г) СН3–СН=СН2.
5. Сумма коэффициентов в уравнении реакции железа с хлором равна:
- а) 4;
- б) 5;
- в) 6;
- г) 7.