§ 18. Классификация и общие характеристики химических реакций
Химические превращения можно классифицировать по ряду критериев.
1. По числу и составу исходных, а также образующихся веществ различают реакции соединения, разложения, замещения и обмена.
Реакция соединения — это химическое превращение, в результате которого из двух или более веществ образуется одно новое вещество:
В реакциях соединения могут участвовать как простые, так и сложные вещества, но продуктами являются только сложные вещества.
Реакция разложения — это химическое превращение, в результате которого из одного сложного вещества образуется несколько новых — простых или сложных:
Разложению подвергаются только сложные вещества.
Реакция замещения — это химическое превращение, в результате которого атомы простого вещества замещают атомы одного из элементов в сложном:
Реакция обмена — это химическое превращение, в результате которого два сложных вещества обмениваются своими составными частями.
Например:
или в ионной форме, известной вам с 9-го класса:
2. По признаку изменения степеней окисления атомов в химических превращениях выделяют окислительно-восстановительные реакции и реакции без изменения степени окисления атомов.
Реакции обмена, некоторые реакции соединения и разложения протекают без изменения степени окисления атомов:
Реакции замещения, некоторые реакции разложения и соединения сопровождаются изменением степеней окисления атомов:
Отметим, что изменением степеней окисления атомов сопровождаются почти все реакции с участием простых веществ.
Окислительно-восстановительные реакции осуществляются за счёт перехода электронов от атомов одних элементов к атомам других, в результате чего и происходит изменение степеней окисления. При этом число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Это равенство называется, как вам известно, электронным балансом и используется для расстановки коэффициентов в уравнениях окислительно-восстановительных реакций.
Пример 1. Расставьте коэффициенты в уравнении реакции промышленного получения оксида азота(II) из аммиака:
Решение
Как видно из схемы, атом азота N повышает степень окисления от –3 до +2, значит, теряет 5 электронов. Каждый из двух атомов кислорода O понижает степень окисления от 0 до –2, следовательно, двухатомная молекула кислорода присоединяет 4 электрона:
Наименьшее общее кратное для чисел 4 и 5 равно 20. Коэффициенты находим делением кратного на число электронов. Они представляют собой множители для достижения электронного баланса 20 электронов:
| 5 | 20 | x 4 | восстановитель | окисляется | |
| 4 | x 5 | окислитель | восстанавливается |
Расставим коэффициенты:
3. По признаку выделения или поглощения теплоты химические реакции подразделяют на экзотермические и эндотермические.
Экзотермическими называют реакции, сопровождающиеся выделением теплоты во внешнюю среду.
Выделяющуюся теплоту в уравнении реакции обозначают символом Q со знаком плюс, указывая таким образом, что система передаёт свою энергию окружающей среде. Энергия может передаваться также в виде светового излучения или электрической энергии. Обычно экзотермические реакции используют для получения теплоты. Типичный пример — реакция горения метана:
Эндотермическими называют реакции, сопровождающиеся поглощением теплоты из внешней среды. Убывающую теплоту в уравнении реакции обозначают символом Q со знаком минус:
4. По признаку полноты превращения исходных веществ в конечные химические реакции делят на необратимые и обратимые.
Необратимыми называют химические реакции, протекающие в данных условиях с полным превращением хотя бы одного из исходных веществ в продукты реакции.
Если реагирующие вещества взяты в стехиометрических количествах, то все они прореагируют полностью в случае необратимой химической реакции.
К необратимым относятся реакции с интенсивным выделением теплоты (например, горения: ), а также реакции в растворах с образованием малорастворимых (
), газообразных (
) или малодиссоциирующих (например, воды) веществ:
Обратимыми называют химические реакции, способные протекать в данных условиях одновременно в прямом и обратном направлениях. В ходе обратимой реакции исходные вещества превращаются в продукты не полностью потому, что одновременно из продуктов образуются исходные вещества.
В уравнениях обратимых реакций знак равенства заменяют противоположно направленными стрелками. Например, обратимы реакции получения оксида серы(VI):
а также взаимодействия азота с кислородом, которое становится ощутимым лишь выше 2000 °С и протекает в атмосфере при разрядах молнии.
5. По условиям проведения реакции делят на каталитические и некаталитические.
Каталитические реакции протекают с участием катализаторов.
Катализаторы — это вещества, которые ускоряют химические реакции, но не входят в состав продуктов превращений.
Катализатор указывают над знаком равенства или обратимости реакции, как правило, с краткими обозначениями условий её протекания (t, р), на пример:
Многие реакции протекают с достаточной скоростью только в присутствии катализатора. Так, известно, что чистый пероксид водорода устойчив и разлагается при 20 °С со скоростью менее 0,5 % в год. Однако при наличии малого количества примесей, например соединений меди, железа, марганца, серебра, многих органических веществ, пероксид водорода неустойчив даже в разбавленных растворах:
6. По наличию границы раздела фаз выделяют реакции гомогенные и гетерогенные. Химические реакции, протекающие во всём объёме однородной реакционной среды (например, в смеси газов, в растворе двух солей в воде), называют гомогенными. Например:
Реакции, протекающие на поверхности соприкосновения разных веществ в неоднородной среде, являются гетерогенными. Такую поверхность называют границей раздела фаз, понимая под фазой однородную по составу и свойствам часть системы. Например, в реакции меди с концентрированной серной кислотой, уравнение которой:
твёрдая медь отделена от жидкой серной кислоты видимой границей — поверхностью кусочка меди. С поверхности меди поднимаются пузырьки газа — SO2. Эта реакция является гетерогенной. К гетерогенным относят реакции растворения металлов и их оксидов в кислотах, горение твёрдых веществ в кислороде, взаимодействие между кислотными и основными оксидами и др.
В качестве примера гетерогенной химической реакции можно привести высокотемпературный процесс получения железа из оксида железа Fe2O3:
Гетерогенные химические реакции протекают на поверхности соприкосновения реагирующих веществ.
Гомогенными называют химические реакции, протекающие в однородной среде в отсутствие поверхности соприкосновения разных веществ.
В ряде случаев реакции, медленно протекающие в растворах или в пара́х, ускоряются при введении твёрдого катализатора. Так, известная вам реакция синтеза аммиака из азота и водорода ускоряется в присутствии железа; V2O5 применяют в реакции окисления SO2 при синтезе серной кислоты. По признаку наличия границы раздела фаз эти реакции относят к гетерогенным, называя их реакциями гетерогенного катализа.
Пример 2. Дайте характеристику реакции горения железа в хлоре, протекающей с образованием хлорида железа(III) и сопровождающейся интенсивным выделением теплоты и света.
Решение
Составим уравнение реакции и отметим степени окисления атомов, агрегатное состояние исходных веществ и тепловой эффект:
Укажем, что это реакция:
- 1) соединения, так как из двух простых исходных веществ — железа и хлора образуется одно новое — сложное вещество хлорид железа(III);
- 2) окислительно-восстановительная, так как в ходе реакции изменяются степени окисления атомов железа и хлора;
- 3) экзотермическая, потому что горение сопровождается выделением теплоты;
- 4) необратимая как реакция горения с интенсивным выделением теплоты;
- 5) некаталитическая, так как протекает без катализатора;
- 6) гетерогенная, так как протекает на поверхности раздела твёрдого и газообразного веществ.
Классификация реакций в органической химии
При классификации реакций в органической химии различают реакции: замещения атома или групп атомов в молекуле органического соединения; присоединения атомов или групп атомов к молекуле органического соединения; отщепления атомов от молекулы без разрыва связей ; разложения как процесса разрыва связей с образованием более простых веществ; изомеризации как процесса изменения строения молекулы с сохранением её состава.
Примерами могут служить следующие превращения:
и (замещение);
(присоединение);
(отщепление);
(разложение);
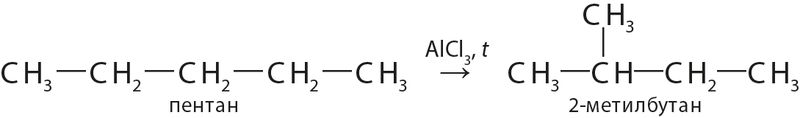 (изомеризация).
(изомеризация).По признаку изменения степеней окисления атомов в молекуле органического вещества, как и в случае неорганических веществ, различают реакции окисления (с участием кислорода, перманганата калия КМnO4, хромата и дихромата калия — K2CrO4 и K2Cr2O7 и др.) и реакции восстановления (с участием водорода, LiAlH4 и др.):
(окисление);
(восстановление).