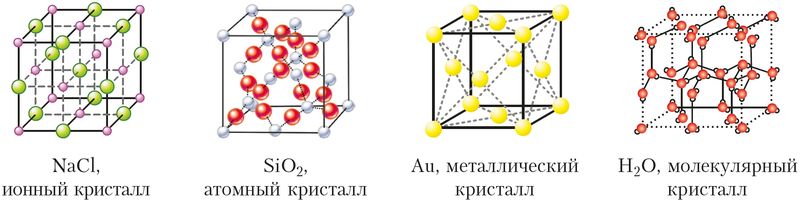
§ 16. Типы кристаллических структур
Химическая связь в кристаллах
В таблице 13 обобщены основные характеристики кристаллических веществ с различным типом химической связи.
Таблица 13. Типы кристаллов и их свойства
| Структурные единицы, свойства | Типы кристаллов, структурные единицы | |||
| Атомные | Ионные | Металлические | Молекулярные | |
| Атомы неметаллов | Ионы | Атомы металлов | Молекулы | |
| Тип связи и её прочность | Ковалентная, прочная | Ионная, прочная | Металлическая, прочность в широком диапазоне | Слабое межмолекулярное взаимодействие |
| Электро- и теплопроводность | От диэлектриков до полупроводников | Ток проводят растворы и расплавы | Хорошая электро- и теплопроводность | Низкая теплопроводность, как правило, диэлектрики |
| Пластичность | Хрупкие | Хрупкие | В основном пластичные (ковкие) | Неорганические вещества, как правило, хрупкие |
| Твёрдость | Высокая | Высокая | Изменяется в широких пределах | Как правило, низкая, исключение — фуллерит |
| Температуры плавления и кипения | Очень высокие | От средних до высоких | Большой диапазон | Низкие |
| Растворимость | Нерастворимы | Могут растворяться в воде и др. полярных растворителях | Нерастворимы либо могут взаимодействовать с водой | Могут растворяться в полярных или неполярных растворителях |
| Примеры веществ | Алмаз, графит, кремний, SiO2, SiС | Оксиды, гидроксиды и соли щелочных и щёлочноземельных металлов | Металлы, металлические сплавы | Кислоты, оксиды неметаллов (кроме кремния), неметаллы (например, P4, S8, I2), органические вещества |
Различают атомные (ковалентная связь), ионные (ионная связь), металлические (металлическая связь) и молекулярные кристаллы. Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями, а между молекулами действуют более слабые межмолекулярные силы. Молекулярные кристаллы образуют известные вам сахар, аспирин, диоксид углерода («сухой лёд»), вода (лёд) (рис. 37).