§ 17. Межмолекулярное взаимодействие и водородная связь
Межмолекулярное взаимодействие
Вещества молекулярного строения могут существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Но температурные условия того или иного состояния для каждого из веществ индивидуальны.
Причина здесь одна — различие в силе взаимодействия между молекулами. Это взаимодействие называют межмолекулярным. Как и химическая связь, межмолекулярное взаимодействие осуществляется за счёт сил электростатического притяжения, но в десятки и сотни раз более слабых. Чем сильнее межмолекулярное взаимодействие в веществе, тем выше его температура плавления и кипения. Сила межмолекулярного взаимодействия — индивидуальная характеристика вещества, она зависит от электронного строения его молекул.
Молекула в целом является электронейтральной частицей, но внутри молекулы находятся положительно заряженные ядра, окружённые электронами. В зависимости от полярности и направленности химических связей внутри молекулы на атомах могут возникать заряды. Так, в молекуле HCl связь между атомами полярная и общая электронная пара смещена к более электроотрицательному атому хлора. В результате в одной части молекулы — на атоме хлора — возникает частичный отрицательный заряд, в другой — на атоме водорода — частичный положительный заряд. Образуются диполи . Между ними возникает электростатическое притяжение (рис. 40, а; 41, а).
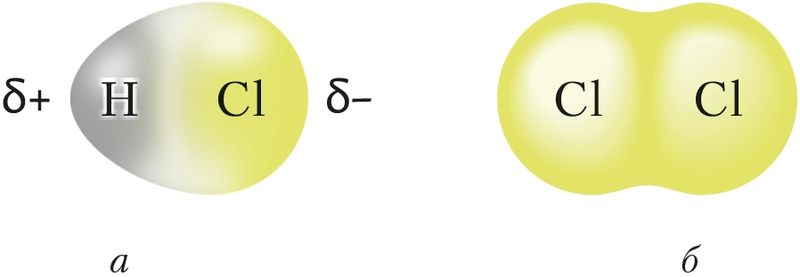
Слабое электростатическое притяжение существует и между неполярными молекулами, например хлора. Оно объясняется образованием мгновенных диполей в результате движения электронов в атомах, принадлежащих соседним молекулам (рис. 40, б; 41, б).
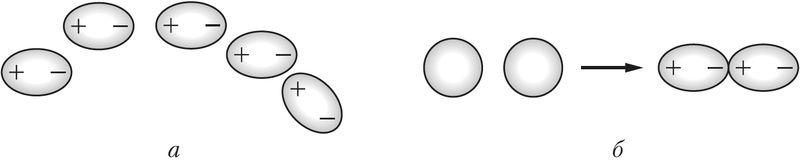
б — между неполярными молекулами (образуются мгновенные диполи)
Следует иметь в виду, что молекулы с полярными связями могут быть в целом неполярными, то есть не представлять собой диполи. Например, молекулы имеют линейное строение. Однако молекулы воды представляют собой диполи, так как имеют угловое строение (рис. 33, с. 81).
Величина сил межмолекулярного взаимодействия зависит от размеров молекул. Чем больше молекула, тем легче её внешние электроны притягиваются к другой молекуле и тем прочнее межмолекулярное взаимодействие. Этим объясняется переход от газообразного (F2, Cl2) к жидкому (Br2) и твёрдому (I2) состояниям вещества в ряду галогенов. Как известно, от фтора к йоду по группе радиус атомов растёт. Соответственно, растут и размеры образуемых ими молекул (табл. 14).
Таблица 14. Характеристики молекул галогенов
| Вещество | Фтор | Хлор | Бром | Йод |
| Модели молекул и их размеры | 0,142 нм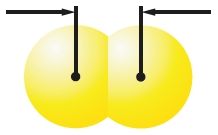 F2 |
0,198 нм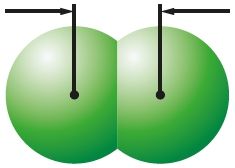 Cl2 |
0,228 нм Br2 |
0,266 нм I2 |
| Температуры кипения, °C | –188,2 | –34,1 | +58,8 | +184,4 |