§ 16. Типы кристаллических структур
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 16. Типы кристаллических структур |
| Напечатано:: | Гость |
| Дата: | Tuesday, 25 November 2025, 12:44 |
Свойства веществ в твёрдом агрегатном состоянии определяются не только составом атомов, ионов, молекул, но и их взаимным расположением.
Расположение структурных единиц может быть упорядоченным и разупорядоченным. В соответствии с этим твёрдые вещества бывают в кристаллическом и аморфном состояниях.

Кристаллы — это твёрдые вещества с упорядоченным расположением структурных единиц (атомов, ионов, молекул). Кристаллы имеют естественную форму многогранников, расположение структурных единиц симметрично и многократно повторяется (рис. 35).
Структурные единицы веществ молекулярного строения — это молекулы. Например, структурной единицей воды является молекула состава Н2О, которая обнаруживается в твёрдом, жидком и газообразном состояниях. Однако лишь в кристаллах льда молекулы воды расположены упорядоченно, то есть на конкретном расстоянии, под определённым углом, образуя регулярную кристаллическую структуру.
В веществах немолекулярного строения мельчайшие структурные единицы — это атомы или ионы. К таким веществам относятся металлы (Na, Cu, Fe) и неметаллы (B и Si, алмаз и графит, красный фосфор), соединения металлов с неметаллами (NaCl, NaH, Na2SO4, CuCl2, Fe2O3) и неметаллов с неметаллами (SiC, SiO2).
В аморфном состоянии упорядоченность в расположении структурных единиц отсутствует. В аморфном состоянии находятся, например, стекло, смола, парафин, полиэтилен, сажа.
Строение, свойства и способы получения кристаллических веществ изучает кристаллохимия. Каждому кристаллическому веществу присуща своя кристаллическая структура и соответствующая ей форма кристаллов (рис. 36). Кристаллы галита (NaCl) имеют форму куба, кристаллы кварца (SiO2) — шестигранной призмы.

Строение молекул показывают посредством структурных формул, а пространственное расположение атомов, ионов, молекул в кристаллах отображают с помощью кристаллической решётки.
Если соединить частицы, составляющие кристалл, условными линиями, то получится пространственный каркас, называемый кристаллической решёткой. Точки пересечения таких линий называют узлами кристаллической решётки. Положение узлов решётки моделирует расположение структурных единиц кристалла — атомов, ионов или молекул.
Химическая связь в кристаллах
В таблице 13 обобщены основные характеристики кристаллических веществ с различным типом химической связи.
Таблица 13. Типы кристаллов и их свойства
| Структурные единицы, свойства | Типы кристаллов, структурные единицы | |||
| Атомные | Ионные | Металлические | Молекулярные | |
| Атомы неметаллов | Ионы | Атомы металлов | Молекулы | |
| Тип связи и её прочность | Ковалентная, прочная | Ионная, прочная | Металлическая, прочность в широком диапазоне | Слабое межмолекулярное взаимодействие |
| Электро- и теплопроводность | От диэлектриков до полупроводников | Ток проводят растворы и расплавы | Хорошая электро- и теплопроводность | Низкая теплопроводность, как правило, диэлектрики |
| Пластичность | Хрупкие | Хрупкие | В основном пластичные (ковкие) | Неорганические вещества, как правило, хрупкие |
| Твёрдость | Высокая | Высокая | Изменяется в широких пределах | Как правило, низкая, исключение — фуллерит |
| Температуры плавления и кипения | Очень высокие | От средних до высоких | Большой диапазон | Низкие |
| Растворимость | Нерастворимы | Могут растворяться в воде и др. полярных растворителях | Нерастворимы либо могут взаимодействовать с водой | Могут растворяться в полярных или неполярных растворителях |
| Примеры веществ | Алмаз, графит, кремний, SiO2, SiС | Оксиды, гидроксиды и соли щелочных и щёлочноземельных металлов | Металлы, металлические сплавы | Кислоты, оксиды неметаллов (кроме кремния), неметаллы (например, P4, S8, I2), органические вещества |
Различают атомные (ковалентная связь), ионные (ионная связь), металлические (металлическая связь) и молекулярные кристаллы. Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями, а между молекулами действуют более слабые межмолекулярные силы. Молекулярные кристаллы образуют известные вам сахар, аспирин, диоксид углерода («сухой лёд»), вода (лёд) (рис. 37).

Зависимость свойств веществ от типа кристаллической структуры
Свойства твёрдых веществ зависят от строения кристаллов и прочности в них химических связей. Например, углерод образует несколько разновидностей кристаллических структур. Одна из них — структура алмаза, в которой каждый атом углерода образует четыре равные по прочности ковалентные связи с четырьмя соседними атомами углерода, расположенными в вершинах тетраэдра (рис. 38). Благодаря своему строению алмаз — самое твёрдое природное вещество (Приложение 2). Аналогичные кристаллические структуры и близкую к алмазу твёрдость имеют карборунд SiC и боразон BN.
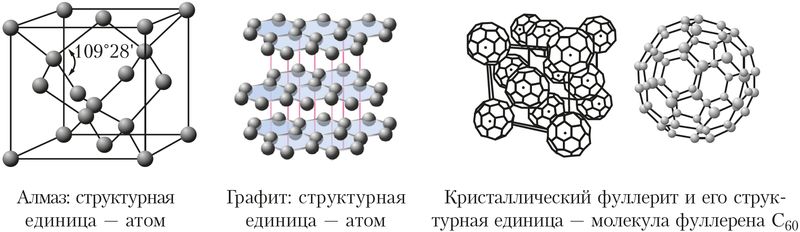
Другая разновидность кристаллического углерода — графит. В графите атомы углерода расположены слоями. В слоях каждый атом углерода использует три своих электрона для образования трёх ковалентных связей с соседними атомами. Четвёртый электрон участвует в образовании делокализованных π-связей и может свободно перемещаться вдоль слоя. Поэтому графит обладает электропроводностью и используется для изготовления электроконтактов, проводящих смазок, электродов и др.
Расстояние между слоями графита значительно больше, чем между атомами в слое. Поэтому графит легко расслаивается. Благодаря этому свойству из графита изготавливают грифели карандашей, он входит в состав различных смазок, снижающих трение, и сам является твёрдой смазкой в формах для литья металлов.
Третья кристаллическая модификация углерода — фуллерит — образована молекулами фуллерена С60, состоящими из 60 атомов углерода.
Атомные, ионные и металлические кристаллы различаются устойчивостью к механической деформации, в результате которой происходит смещение отдельных слоёв кристаллической структуры (рис. 39). При этом сцепление между слоями в атомных кристаллах (а) нарушается из-за разрыва химических связей между атомами, а в ионных — из-за отталкивания одноимённо заряженных ионов (б). В металлических кристаллах благодаря особенностям металлической связи кристаллы не разрушаются, а деформируются. Поэтому металлы пластичны (ковки), а атомные и ионные кристаллы — хрупки.
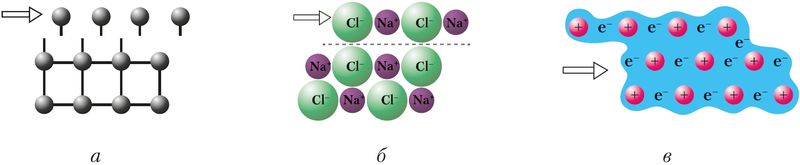
а — атомных, б — ионных, в — металлических
Кристаллы — это твёрдые вещества с упорядоченным расположением структурных единиц (атомов, ионов, молекул).
По строению выделяют четыре типа кристаллов: атомные, ионные, молекулярные и металлические. Они отличаются своими свойствами.
Вопросы, задания, задачи
1. В чём заключаются основные отличия веществ молекулярного и немолекулярного строения? Приведите примеры.
2. Сравните свойства атомных, молекулярных, ионных и металлических кристаллов.
3. Объясните, почему ионные и молекулярные кристаллы практически не проводят электрический ток. Чем обусловлена хорошая электро- и теплопроводность металлических кристаллов?
4. Могут ли проводить ток вещества:
- а) с ионной связью;
- б) ковалентной связью?
Приведите примеры и условия проявления этими веществами электропроводности.
5. Определите типы химической связи и типы кристаллов веществ, формулы которых: SO2, SiС, CsF, K2SO4, Cu6Sn5.
6. Конструктору понадобилось очень твёрдое вещество, устойчивое к действию высоких температур и растворителей. Какое из соединений, перечисленных в задаче 5, он может использовать в своих испытаниях?
7. Объясните, почему графит обладает электропроводностью, а алмаз — нет.
8. Сплав Розе (tпл. +94 °C) используется в плавких электрических предохранителях, а также в радиотехнике в качестве припоя. Состав сплава (по массе): свинец (25 %), висмут (50 %), олово (25 %). Укажите тип его кристаллов. Рассчитайте массу каждого компонента, необходимого для получения сплава массой 5 кг.
9. Рассчитайте мольное соотношение компонентов в сплаве Вуда. Сплав Вуда — тяжёлый легкоплавкий сплав, изобретённый в 1860 году американским дантистом Вудом. Температура плавления — 68,5 °C. Состав (массовые доли): олово — 12,5 %, свинец — 25 %, висмут — 50 %, кадмий — 12,5 %. Какими другими физическими свойствами может, по вашему мнению, обладать этот сплав?
10. Определите число атомов в порции массой 1 г одного из самых твёрдых синтетических веществ, представляющего собой бинарное соединение бора и азота BN.
*Самоконтроль
1. Выделяют типы кристаллов:
- а) атомные;
- б) ионные;
- в) ковалентные;
- г) молекулярные.
2. Ионные кристаллы имеет вещество состава:
- а) KBr;
- б) H2S;
- в) C6H5OH;
- г) SiO2.
3. Атомные кристаллы образуют:
- а) KСl;
- б) Na2SO4;
- в) SiO2;
- г) SiС.
4. Молекулярные кристаллы образуют:
- а) Сs2S;
- б) Н2;
- в) РН3;
- г) HCl.
5. Пластичным и хрупким соответственно являются вещества в па́ре:
- а) NаCl и S8;
- б) Au и Сu;
- в) KCl и Fe;
- г) Al и NH4NO3.