§ 5. Ураўненне стану ідэальнага газу
Практыкаванне 4
1. Вызначце колькасць рэчыва ідэальнага газу, які знаходзіцца ў пасудзіне ёмістасцю V = 480 см3 пры нармальных умовах (атмасферны ціск р0 = 1,0 · 105 Па, тэмпература t0 = 0,0 °С).
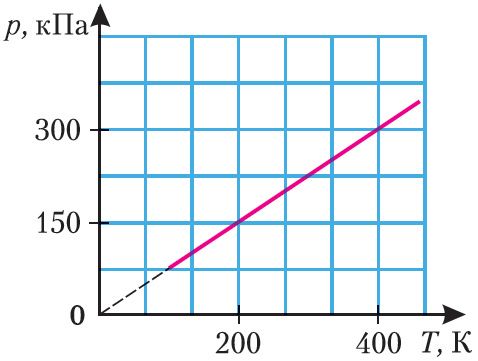
2. На малюнку 20 прыведзены графік залеж насці ціску вадароду, маса якога m = 100 г, ад абсалютнай тэмпературы. Вызначце аб’ём, які займае газ.
3. Балон ёмістасцю V1 = 15 л, дзе знаходзіцца газ, ціск якога p1 = 2,0 · 106 Па, злучылі з пустым балонам ёмістасцю V2 = 5,0 л. Вызначце ціск газу, які ўстанавіўся ў балонах, калі тэмпература пасля расшырэння газу праз некаторы прамежак часу стала такой, як і да расшырэння.
4. Азот, аб’ём якога V1 = 2,9 м3, тэмпература Т1 = 293 К і ціск p1 = 2,0 · 105 Па, перавялі ў вадкі стан. Вызначце аб’ём, які зай мае вадкі азот, калі яго шчыльнасць ρ = 0,86 .
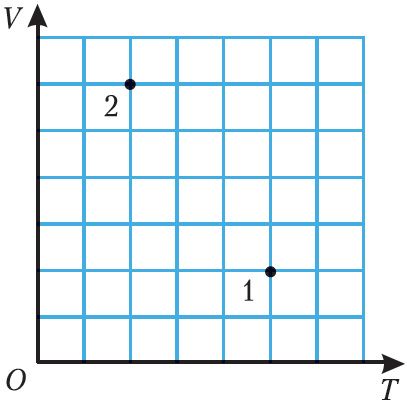
5. На малюнку 21 пункты 1 і 2 адпавядаюць розным станам ідэальнага газу пэўнай масы. Вызначце, у колькі разоў адрозніваюцца ціскі газу ў станах 1 і 2.
![]()
6. У пасудзіне ўмяшчальнасцю V = 2,0 л знаходзяцца кісларод масай m1 = 4,0 г і азот масай m2 = 7,0 г. Вызначце ціск сумесі газаў, калі яе абсалютная тэмпература Т = 300 К.
7. У балоне ўмяшчальнасцю V = 12 л знаходзіўся ідэальны газ, першапачатковыя ціск і тэмпература якога p1 = 1,2 · 105 Па і t1 = 27 °С. Пасля таго як з балона выпусцілі частку газу, у ім устанавілася тэмпература t2 = 17 °С. Вызначце ціск газу, што застаўся ў балоне, калі колькасць рэчыва выпушчанага газу ν1 – ν2 = 0,10 моль.
8. Вакууміраваная цыліндрычная пасудзіна ўмяшчальнасцю V = 2 л падзелена на дзве роўныя часткі тонкай перагародкай, якая прапускае толькі малекулы вадароду. У адну з частак пасудзіны ўпусцілі вадарод Н2 і азот N2, масы якіх m1 = 4 г і m2 = 14 г адпаведна. Вызначце ціск сумесі газаў, калі пры дасягненні цеплавой раўнавагі абсалютная тэмпература сістэмы склала Т = 320 К.