§ 5. Ураўненне стану ідэальнага газу
Высветлім, як звязаны паміж сабой макраскапічныя параметры ідэальнага газу, якія характарызуюць яго раўнаважны стан: ціск, маса ўсяго газу, адведзены яму аб’ём і тэмпература.
Стан макраскапічнай сістэмы цалкам вызначаны, калі вядомыя яе макраскапічныя параметры — ціск p, маса m, тэмпература T і аб’ём V. Ураўненне, якое звязвае параметры дадзенага стану, называюць ураўненнем стану сістэмы. Змяненне параметраў стану сістэмы з цягам часу называюць працэсам.
Калі пры пераходзе ідэальнага газу з аднаго стану ў другі колькасць яго малекул застаецца пастаяннай, гэта значыць маса і малярная маса газу не змяняюцца, то з ураўненняў
і
вынікае:
,
,
(5.1)
дзе k — пастаянная Больцмана; p1, V1, T1 — параметры пачатковага стану газу, а p2, V2, T2 — канчатковага. З суадносін (5.1) вынікае, што
або
(5.2)
Пры нязменных масе і малярнай масе ідэальнага газу адносіны здабытку яго ціску і аб’ёму да абсалютнай тэмпературы з’яўляюцца велічынёй пастаяннай.
Ураўненне (5.2) звязвае два станы ідэальнага газу незалежна ад таго, якім чынам газ перайшоў з аднаго стану ў другі.
Ураўненне стану ў выглядзе (5.2) упершыню вывеў у 1834 г. французскі фізік Бенуа Клапейрон (1799–1864), таму яго называюць ураўненнем Клапейрона.
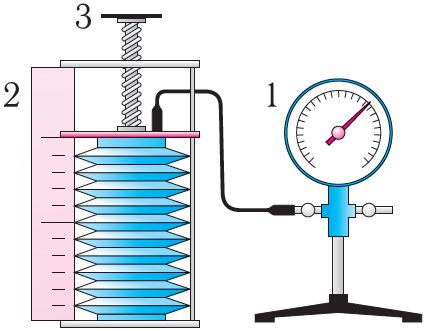
У праўдзівасці ўраўнення стану можна пераканацца, выкарыстаўшы прыладу, паказаную на малюнку 18. Манометрам 1, які злучаны з герметычнай гафрыраванай пасудзінай, рэгіструюць ціск газу ўнутры пасудзіны. Аб’ём газу ў пасудзіне можна разлічыць з дапамогай лінейкі 2. Тэмпература газу ў пасудзіне роўная тэмпературы навакольнага асяроддзя, і яе можа вымераць тэрмометрам.
Вызначыўшы параметры газу p1, V1, T1 у пачатковым стане, вылічваюць адносіны . Пасля гэтага змяшчаюць пасудзіну ў гарачую ваду, тым самым змяняючы тэмпературу газу і яго ціск. Верцячы вінт 3, змяняюць умяшчальнасць пасудзіны. Вымераўшы зноў ціск газу p2 і тэмпературу T2, а таксама разлічыўшы адведзены яму аб’ём V2, вылічваюць адносіны
. Як паказваюць разлікі, ураўненне стану (5.2) выконваецца ў межах хібнасці эксперымента.
Ураўненне стану (5.2) можна прымяняць для газаў пры наступных умовах:
1) не вельмі значныя ціскі (пакуль уласны аб’ём усіх малекул газу надзвычай малы ў параўнанні з умяшчальнасцю ёмістасці, у якой знаходзіцца газ);
2) не вельмі нізкія або высокія тэмпературы (пакуль абсалютнае значэнне патэнцыяльнай энергіі міжмалекулярнага ўзаемадзеяння надзвычай малое ў параўнанні з кінетычнай энергіяй цеплавога руху малекул).
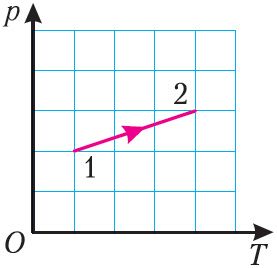
На малюнку 19 прыведзены графік працэсу пераходу ідэальнага газу дадзенай масы са стану 1 у стан 2. Як змяніўся аб’ём газу ў выніку гэтага працэсу?
Паколькі колькасць часціц , то з ураўнення (5.1) вынікае:
(5.3)
Велічыню, роўную здабытку пастаяннай Больцмана k і пастаяннай Авагадра NA, назвалі ўніверсальнай газавай пастаяннай R:
(5.4)
З улікам выразу (5.4) ураўненне (5.3) прыме выгляд:
(5.5)
Паколькі колькасць рэчыва , то формулу (5.5) можна запісаць у выглядзе:
pV = νRT.
Ураўненне стану ў выглядзе (5.5) упершыню было атрыманае рускім вучоным Д. І. Мендзялеевым (1834–1907) у 1874 г., таму яго называюць ураўненнем Клапейрона — Мендзялеева.
Адзначым, што ўраўненне Клапейрона — Мендзялеева звязвае паміж сабой макраскапічныя параметры канкрэтнага стану ідэальнага газу. Выкарыстоўваючы ўраўненне Клапейрона — Мендзялеева, можна апісаць розныя працэсы, якія адбываюцца ў ідэальным газе.