§ 45. Будова і фізічныя ўласцівасці амінаў
Фізічныя ўласцівасці амінаў
У табліцы 45.1 прыведзены структурныя формулы, назвы і тэмпературы кіпення некаторых насычаных амінаў.
| Формула | Назва | tкіп, °C |
| CH3 |
метыламін | –6 |
| CH3 |
этыламін | 17 |
| CH3 |
прапіламін | 49 |
| CH3 |
бутыламін | 78 |
З даных табліцы відаць, што толькі метыламін мае тэмпературу кіпення ніжэй за 0 °С, такім чынам, пры нармальных умовах толькі метыламін з’яўляецца газам.
Больш высокія, у параўнанні з вуглевадародамі, тэмпературы кіпення амінаў абумоўлены ўтварэннем вадародных сувязей паміж іх малекуламі:
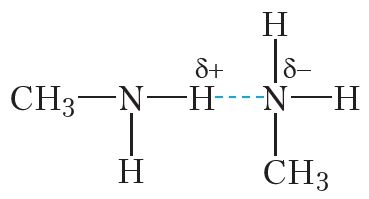
Палярнасць сувязі N ![]() H ніжэй, чым сувязі O
H ніжэй, чым сувязі O ![]() H. Таму тэмпературы кіпення амінаў ніжэйшыя, чым спіртоў з тым самым лікам атамаў вугляроду.
H. Таму тэмпературы кіпення амінаў ніжэйшыя, чым спіртоў з тым самым лікам атамаў вугляроду.
Падобна аміяку, ніжэйшыя аміны добра растваральныя ў вадзе. З ростам вуглевадародных радыкалаў растваральнасць амінаў у вадзе памяншаецца. Напрыклад, анілін маларастваральны ў вадзе. У 100 г вады пры пакаёвай тэмпературы можна растварыць прыкладна 3,5 г аніліну.
Аміны можна разглядаць як вытворныя аміяку, у малекуле якога адзін, два ці тры атамы вадароду замешчаны на вуглевадародныя радыкалы.
У залежнасці ад ліку замешчаных атамаў вадароду аміны падзяляюць на першасныя (замешчаны адзін атам вадароду), другасныя (замешчаны два атамы вадароду) і трацічныя (замешчаны тры атамы вадароду).
У малекулах амінаў, як і ў малекуле аміяку, у атама азоту маецца непадзеленая электронная пара. Таму аміны могуць далучаць катыён вадароду H+ і з’яўляюцца арганічнымі асновамі.
Дзякуючы наяўнасці палярных сувязей N ![]() H паміж малекуламі амінаў могуць утварацца вадародныя сувязі. Таму тэмпературы кіпення амінаў вышэйшыя, чым тэмпературы кіпення алканаў з такім самым лікам атамаў вугляроду ў малекулах.
H паміж малекуламі амінаў могуць утварацца вадародныя сувязі. Таму тэмпературы кіпення амінаў вышэйшыя, чым тэмпературы кіпення алканаў з такім самым лікам атамаў вугляроду ў малекулах.
Ніжэйшыя аміны добра растваральныя ў вадзе. З ростам вуглевадародных радыкалаў растваральнасць амінаў у вадзе памяншаецца.