§ 45. Будова і фізічныя ўласцівасці амінаў
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | § 45. Будова і фізічныя ўласцівасці амінаў |
| Напечатано:: | Гость |
| Дата: | Суббота, 5 Июль 2025, 03:07 |
Будова і фізічныя ўласцівасці амінаў
Вывучаючы папярэднія параграфы, вы даведаліся аб будове і ўласцівасцях спіртоў, альдэгідаў, карбонавых кіслот, складаных эфіраў, вугляводаў. Малекулы ўсіх гэтых злучэнняў змяшчаюць кісларод, таму яны адносяцца да кіслародзмяшчальных арганічных рэчываў. У той жа час існуе вялікая колькасць арганічных злучэнняў, якія змяшчаюць азот. Гэтымі злучэннямі з’яўляюцца бялкі, нуклеінавыя кіслоты і многія іншыя. Перш чым прыступіць да вывучэння азотзмяшчальных арганічных рэчываў, разгледзім будову і ўласцівасці вядомага вам неарганічнага рэчыва аміяку.
Будова малекулы аміяку і іона амонію. Донарна-акцэптарная сувязь
Формула аміяку — NH3. Разгледзім, як утвараюцца кавалентныя сувязі ў малекуле аміяку. На знешнім электронным слоі атама азоту маецца тры няспараныя электроны:
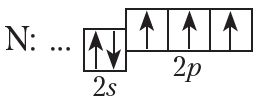
У атаме вадароду — адзін няспараны электрон:
![]()
Тады схему ўтварэння кавалентных сувязей у малекуле аміяку можна прадставіць наступным чынам:
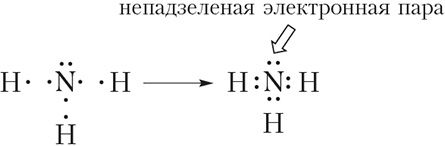
Са схемы відаць, што тры няспараныя электроны атама азоту ўдзельнічаюць ва ўтварэнні трох кавалентных сувязей N ![]() H. У той жа час на знешнім слоі атама азоту застаецца электронная пара. Такая электронная пара называецца непадзеленай электроннай парай. Структурная формула аміяку:
H. У той жа час на знешнім слоі атама азоту застаецца электронная пара. Такая электронная пара называецца непадзеленай электроннай парай. Структурная формула аміяку:
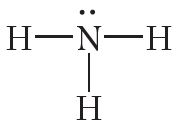
Дзякуючы наяўнасці непадзеленай электроннай пары атам азоту малекулы аміяку можа ўтвараць яшчэ адну кавалентную сувязь. Напрыклад, малекула аміяку здольна далучаць катыён вадароду H+, утвараючы іон амонію:
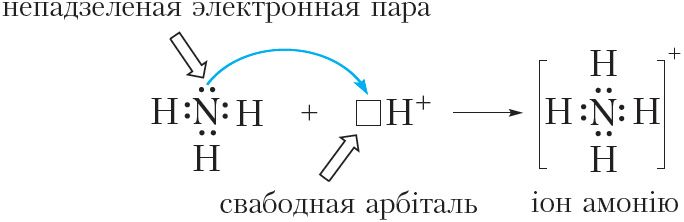
або
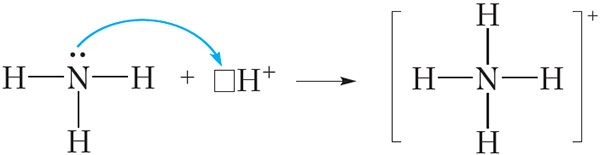
З малюнка 45.2 відаць, што ўсе чатыры кавалентныя сувязі N ![]() H у іоне амонію аднолькавыя. Яны ўтвораны з дапамогай агульных электронных пар паміж атамамі азоту і вадароду. Аднак механізм утварэння гэтых сувязей адрозніваецца. Тры сувязі N
H у іоне амонію аднолькавыя. Яны ўтвораны з дапамогай агульных электронных пар паміж атамамі азоту і вадароду. Аднак механізм утварэння гэтых сувязей адрозніваецца. Тры сувязі N ![]() H утвараюцца за кошт няспараных электронаў атамаў азоту і вадароду (мал. 45.1). Такі спосаб утварэння кавалентнай сувязі называецца абменным. Чацвёртая сувязь N
H утвараюцца за кошт няспараных электронаў атамаў азоту і вадароду (мал. 45.1). Такі спосаб утварэння кавалентнай сувязі называецца абменным. Чацвёртая сувязь N ![]() H у іоне амонію ўтвараецца за кошт непадзеленай электроннай пары атама азоту і свабоднай арбіталі катыёну H+ (мал. 45.2). Такі спосаб утварэння кавалентнай сувязі называецца донарна-акцэптарным. Пры гэтым атам азоту, які прадстаўляе электронную пару, называецца донарам, а катыён вадароду, які прымае электронную пару на сваю свабодную арбіталь, — акцэптарам.
H у іоне амонію ўтвараецца за кошт непадзеленай электроннай пары атама азоту і свабоднай арбіталі катыёну H+ (мал. 45.2). Такі спосаб утварэння кавалентнай сувязі называецца донарна-акцэптарным. Пры гэтым атам азоту, які прадстаўляе электронную пару, называецца донарам, а катыён вадароду, які прымае электронную пару на сваю свабодную арбіталь, — акцэптарам.
Рэчывы, здольныя далучаць катыён вадароду H+, з’яўляюцца асновамі. Такім чынам, аміяк — аснова. Асноўныя ўласцівасці аміяку праяўляюцца ў рэакцыях з кіслотамі. У гэтых рэакцыях утвараюцца солі амонію:
![]()
або
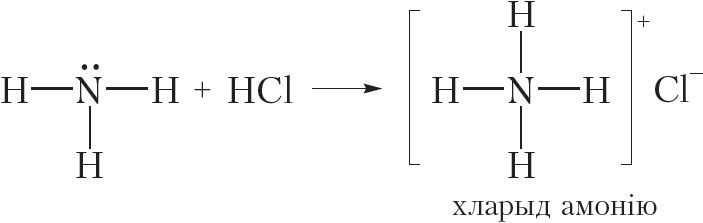
Відаць, што ў рэакцыі з HCl малекула NH3 далучае катыён H+ і ператвараецца ў іон амонію NH4+. У іоне амонію атам азоту ўтварае чатыры кавалентныя сувязі N ![]() H, таму валентнасць азоту роўная IV. У хларыдзе амонію, акрамя кавалентных сувязей N
H, таму валентнасць азоту роўная IV. У хларыдзе амонію, акрамя кавалентных сувязей N ![]() H, маецца іонная сувязь паміж катыёнам NH4+ і аніёнам Cl–.
H, маецца іонная сувязь паміж катыёнам NH4+ і аніёнам Cl–.
Аміяк праяўляе асноўныя ўласцівасці не толькі пры ўзаемадзеянні з кіслотамі, але і з вадой. Так, пры растварэнні аміяку ў вадзе працякае абарачальная рэакцыя:
![]()
або
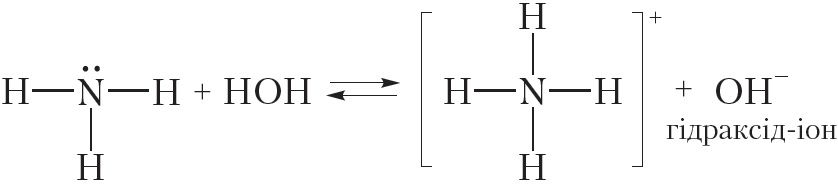
Відаць, што пры ўзаемадзеянні з вадой малекула аміяку далучае катыён вадароду. Пры гэтым утвараюцца іон амонію NH4+ і гідраксід-іон OH–. Наяўнасць іонаў OH– абумоўлівае шчолачную рэакцыю водных раствораў аміяку.
Пяройдзем да разгляду будовы арганічных азотзмяшчальных рэчываў — амінаў.
Будова малекул амінаў
Аміны можна разглядаць як вытворныя аміяку, у малекуле якога адзін, два ці тры атамы вадароду замешчаны на вуглевадародныя радыкалы.
Напрыклад, замесцім адзін атам вадароду малекулы аміяку на метыльны радыкал:
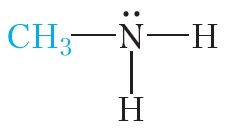
Такое злучэнне называецца метыламін. Метыламін уяўляе сабой бясколерны газ (tкіп = –6 °С) з рэзкім пахам, які нагадвае пах аміяку.
Метыламін з’яўляецца найпрасцейшым прадстаўніком амінаў. Яго формулу можна запісаць наступным чынам: CH3 ![]() NH2. Відаць, што ў малекуле метыламіну маецца група
NH2. Відаць, што ў малекуле метыламіну маецца група ![]() NH2, якая называецца амінагрупай.
NH2, якая называецца амінагрупай.
Калі замясціць два атамы вадароду малекулы аміяку на метыльныя радыкалы, то атрымаецца дыметыламін:
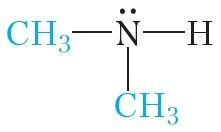
Нарэшце, пры замяшчэнні ўсіх трох атамаў вадароду малекулы аміяку на метыльныя радыкалы атрымаем трыметыламін:
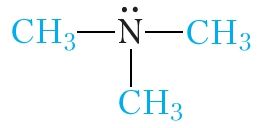
У залежнасці ад ліку замешчаных атамаў вадароду аміны падзяляюць на першасныя (замешчаны адзін атам вадароду), другасныя (замешчаны два атамы вадароду) і трацічныя (замешчаны тры атамы вадароду):

Метыламін CH3 ![]() NH2 з’яўляецца першасным амінам. Улічваючы, што агульная формула алкільных радыкалаў CnH2n+1
NH2 з’яўляецца першасным амінам. Улічваючы, што агульная формула алкільных радыкалаў CnH2n+1 ![]() , лёгка атрымаць агульную формулу гамолагаў метыламіну:
, лёгка атрымаць агульную формулу гамолагаў метыламіну:
![]()
У малекулах амінаў, як і ў малекуле аміяку, у атама азоту маецца непадзеленая электронная пара. Дзякуючы гэтаму аміны, як і аміяк, могуць далучаць катыён вадароду H+. Гэта значыць аміны з’яўляюцца арганічнымі асновамі.
Назвы амінаў складаюцца з назваў вуглевадародных радыкалаў, звязаных з атамам азоту, і канчатка -амін. Прывядзём назвы некаторых амінаў:
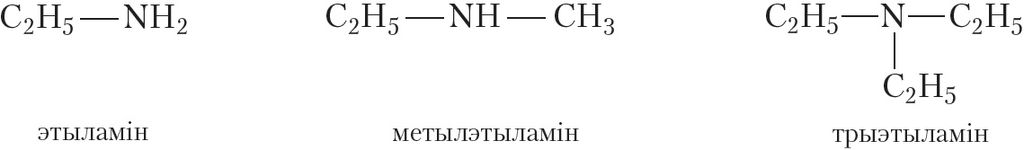
Акрамя алкільных радыкалаў малекулы амінаў могуць змяшчаць і іншыя замяшчальнікі. Прыкладам такога аміну з’яўляецца анілін:
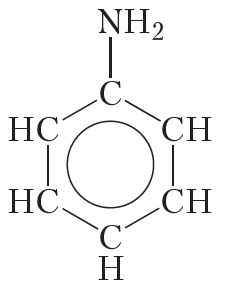
У малекуле аніліну група ![]() NH2 звязана з радыкалам
NH2 звязана з радыкалам ![]() C6H5, які называецца феніл. Таму анілін называюць таксама феніламінам.
C6H5, які называецца феніл. Таму анілін называюць таксама феніламінам.
Анілін уяўляе сабой бясколерную алеістую вадкасць, дрэнна растваральную ў вадзе, з тэмпературай кіпення 184 °С. Анілін ядавіты.
Ізамерыя амінаў
Метыламін CH3 ![]() NH2 не мае ізамераў.
NH2 не мае ізамераў.
Наступныя прадстаўнікі алкіламінаў змяшчаюць два атамы вугляроду ў малекуле. У гэтым выпадку магчыма існаванне двух ізамераў:
![]()
Фізічныя ўласцівасці амінаў
У табліцы 45.1 прыведзены структурныя формулы, назвы і тэмпературы кіпення некаторых насычаных амінаў.
| Формула | Назва | tкіп, °C |
| CH3 |
метыламін | –6 |
| CH3 |
этыламін | 17 |
| CH3 |
прапіламін | 49 |
| CH3 |
бутыламін | 78 |
З даных табліцы відаць, што толькі метыламін мае тэмпературу кіпення ніжэй за 0 °С, такім чынам, пры нармальных умовах толькі метыламін з’яўляецца газам.
Больш высокія, у параўнанні з вуглевадародамі, тэмпературы кіпення амінаў абумоўлены ўтварэннем вадародных сувязей паміж іх малекуламі:
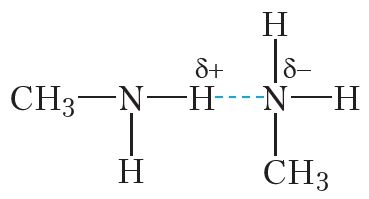
Палярнасць сувязі N ![]() H ніжэй, чым сувязі O
H ніжэй, чым сувязі O ![]() H. Таму тэмпературы кіпення амінаў ніжэйшыя, чым спіртоў з тым самым лікам атамаў вугляроду.
H. Таму тэмпературы кіпення амінаў ніжэйшыя, чым спіртоў з тым самым лікам атамаў вугляроду.
Падобна аміяку, ніжэйшыя аміны добра растваральныя ў вадзе. З ростам вуглевадародных радыкалаў растваральнасць амінаў у вадзе памяншаецца. Напрыклад, анілін маларастваральны ў вадзе. У 100 г вады пры пакаёвай тэмпературы можна растварыць прыкладна 3,5 г аніліну.
Аміны можна разглядаць як вытворныя аміяку, у малекуле якога адзін, два ці тры атамы вадароду замешчаны на вуглевадародныя радыкалы.
У залежнасці ад ліку замешчаных атамаў вадароду аміны падзяляюць на першасныя (замешчаны адзін атам вадароду), другасныя (замешчаны два атамы вадароду) і трацічныя (замешчаны тры атамы вадароду).
У малекулах амінаў, як і ў малекуле аміяку, у атама азоту маецца непадзеленая электронная пара. Таму аміны могуць далучаць катыён вадароду H+ і з’яўляюцца арганічнымі асновамі.
Дзякуючы наяўнасці палярных сувязей N ![]() H паміж малекуламі амінаў могуць утварацца вадародныя сувязі. Таму тэмпературы кіпення амінаў вышэйшыя, чым тэмпературы кіпення алканаў з такім самым лікам атамаў вугляроду ў малекулах.
H паміж малекуламі амінаў могуць утварацца вадародныя сувязі. Таму тэмпературы кіпення амінаў вышэйшыя, чым тэмпературы кіпення алканаў з такім самым лікам атамаў вугляроду ў малекулах.
Ніжэйшыя аміны добра растваральныя ў вадзе. З ростам вуглевадародных радыкалаў растваральнасць амінаў у вадзе памяншаецца.
Пытанні і заданні
1. Прывядзіце прыклады рэакцый, у якіх аміяк праяўляе ўласцівасці асновы. Якая часціца далучаецца да малекулы аміяку ў гэтых рэакцыях?
2. Чаму водны раствор аміяку афарбоўвае фенолфталеін у малінавы колер?
3. Знайдзіце першасныя, другасныя і трацічныя аміны сярод рэчываў, формулы якіх:
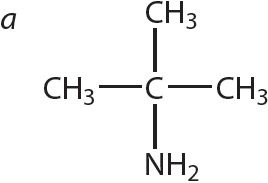
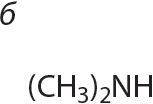
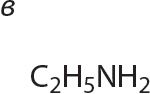
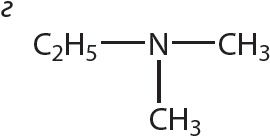
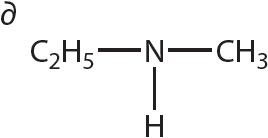
4. Напішыце агульную формулу гамолагаў метыламіну.
5. Напішыце структурныя формулы ўсіх ізамераў прапіламіну.
6. Адлюструйце ўтварэнне вадародных сувязей паміж малекуламі этыламіну. Ці могуць утварацца вадародныя сувязі паміж малекуламі трыметыламіну?
7. Масавая доля вугляроду ў малекуле гамолага метыламіну роўна 61,0 %. Прывядзіце магчымую формулу гэтага рэчыва.