§ 45. Будова і фізічныя ўласцівасці амінаў
Будова малекулы аміяку і іона амонію. Донарна-акцэптарная сувязь
Формула аміяку — NH3. Разгледзім, як утвараюцца кавалентныя сувязі ў малекуле аміяку. На знешнім электронным слоі атама азоту маецца тры няспараныя электроны:
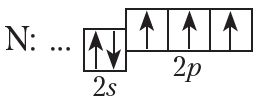
У атаме вадароду — адзін няспараны электрон:
![]()
Тады схему ўтварэння кавалентных сувязей у малекуле аміяку можна прадставіць наступным чынам:
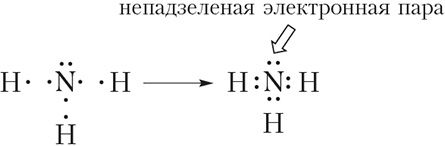
Са схемы відаць, што тры няспараныя электроны атама азоту ўдзельнічаюць ва ўтварэнні трох кавалентных сувязей N ![]() H. У той жа час на знешнім слоі атама азоту застаецца электронная пара. Такая электронная пара называецца непадзеленай электроннай парай. Структурная формула аміяку:
H. У той жа час на знешнім слоі атама азоту застаецца электронная пара. Такая электронная пара называецца непадзеленай электроннай парай. Структурная формула аміяку:
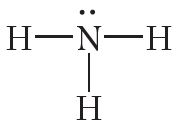
Дзякуючы наяўнасці непадзеленай электроннай пары атам азоту малекулы аміяку можа ўтвараць яшчэ адну кавалентную сувязь. Напрыклад, малекула аміяку здольна далучаць катыён вадароду H+, утвараючы іон амонію:
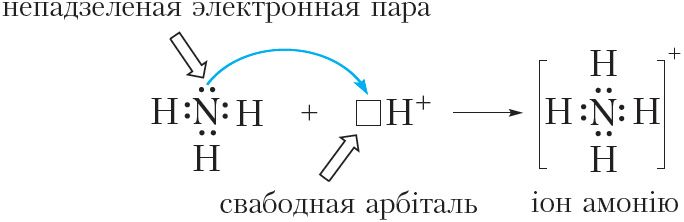
або
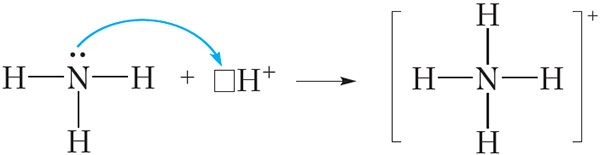
З малюнка 45.2 відаць, што ўсе чатыры кавалентныя сувязі N ![]() H у іоне амонію аднолькавыя. Яны ўтвораны з дапамогай агульных электронных пар паміж атамамі азоту і вадароду. Аднак механізм утварэння гэтых сувязей адрозніваецца. Тры сувязі N
H у іоне амонію аднолькавыя. Яны ўтвораны з дапамогай агульных электронных пар паміж атамамі азоту і вадароду. Аднак механізм утварэння гэтых сувязей адрозніваецца. Тры сувязі N ![]() H утвараюцца за кошт няспараных электронаў атамаў азоту і вадароду (мал. 45.1). Такі спосаб утварэння кавалентнай сувязі называецца абменным. Чацвёртая сувязь N
H утвараюцца за кошт няспараных электронаў атамаў азоту і вадароду (мал. 45.1). Такі спосаб утварэння кавалентнай сувязі называецца абменным. Чацвёртая сувязь N ![]() H у іоне амонію ўтвараецца за кошт непадзеленай электроннай пары атама азоту і свабоднай арбіталі катыёну H+ (мал. 45.2). Такі спосаб утварэння кавалентнай сувязі называецца донарна-акцэптарным. Пры гэтым атам азоту, які прадстаўляе электронную пару, называецца донарам, а катыён вадароду, які прымае электронную пару на сваю свабодную арбіталь, — акцэптарам.
H у іоне амонію ўтвараецца за кошт непадзеленай электроннай пары атама азоту і свабоднай арбіталі катыёну H+ (мал. 45.2). Такі спосаб утварэння кавалентнай сувязі называецца донарна-акцэптарным. Пры гэтым атам азоту, які прадстаўляе электронную пару, называецца донарам, а катыён вадароду, які прымае электронную пару на сваю свабодную арбіталь, — акцэптарам.
Рэчывы, здольныя далучаць катыён вадароду H+, з’яўляюцца асновамі. Такім чынам, аміяк — аснова. Асноўныя ўласцівасці аміяку праяўляюцца ў рэакцыях з кіслотамі. У гэтых рэакцыях утвараюцца солі амонію:
![]()
або
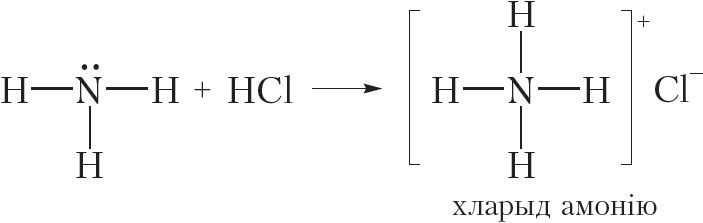
Відаць, што ў рэакцыі з HCl малекула NH3 далучае катыён H+ і ператвараецца ў іон амонію NH4+. У іоне амонію атам азоту ўтварае чатыры кавалентныя сувязі N ![]() H, таму валентнасць азоту роўная IV. У хларыдзе амонію, акрамя кавалентных сувязей N
H, таму валентнасць азоту роўная IV. У хларыдзе амонію, акрамя кавалентных сувязей N ![]() H, маецца іонная сувязь паміж катыёнам NH4+ і аніёнам Cl–.
H, маецца іонная сувязь паміж катыёнам NH4+ і аніёнам Cl–.
Аміяк праяўляе асноўныя ўласцівасці не толькі пры ўзаемадзеянні з кіслотамі, але і з вадой. Так, пры растварэнні аміяку ў вадзе працякае абарачальная рэакцыя:
![]()
або
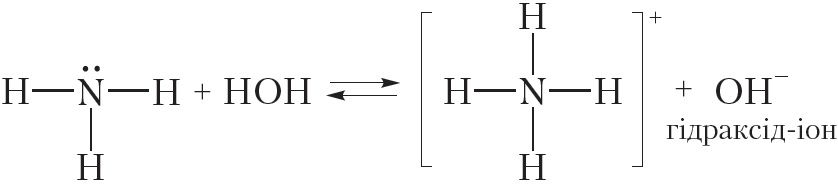
Відаць, што пры ўзаемадзеянні з вадой малекула аміяку далучае катыён вадароду. Пры гэтым утвараюцца іон амонію NH4+ і гідраксід-іон OH–. Наяўнасць іонаў OH– абумоўлівае шчолачную рэакцыю водных раствораў аміяку.
Пяройдзем да разгляду будовы арганічных азотзмяшчальных рэчываў — амінаў.