§ 29. Альдэгіды. Наменклатура. Ізамерыя. Фізічныя ўласцівасці
Фізічныя ўласцівасці альдэгідаў
У табліцы 29.1 прыведзены формулы, назвы і тэмпературы кіпення некаторых альдэгідаў.
| Формула | Назва | tкіп, °С |
| H |
метаналь | –20 |
| CH3 |
этаналь | 21 |
| CH3 |
прапаналь | 49 |
| CH3 |
бутаналь | 76 |
| CH3 |
пентаналь | 103 |
Як відаць з табліцы, тэмпературы кіпення альдэгідаў значна ніжэйшыя, чым спіртоў з такім самым лікам атамаў вугляроду ў малекуле. Так, тэмпература кіпення метанолу роўная +65 °С, а метаналю –20 °С. Гэта сведчыць аб тым, што ўзаемадзеянне паміж малекуламі альдэгідаў слабейшае, чым паміж малекуламі спіртоў.
Нагадаем, што прычынай высокіх тэмператур кіпення спіртоў з’яўляецца наяўнасць паміж іх малекуламі вадародных сувязей. Вадародныя сувязі дастаткова моцна ўтрымліваюць малекулы спіртоў адну каля адной і робяць цяжкім пераход у газападобны стан. Паміж малекуламі альдэгідаў, у адрозненне ад спіртоў, вадародныя сувязі не ўтвараюцца, так як у альдэгідах адсутнічаюць атамы вадароду, звязаныя з атамам кіслароду.
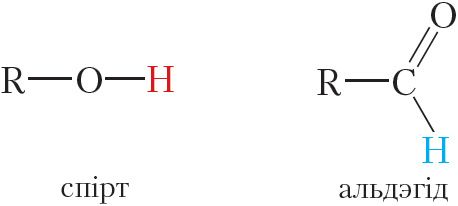
Сувязь C ![]() H альдэгіднай групы з’яўляецца малапалярнай, таму дадатны зарад на атаме вадароду альдэгіднай групы недастатковы для ўтварэння вадароднай сувязі з атамам кіслароду суседняй малекулы. З прычыны гэтага тэмпературы кіпення альдэгідаў ніжэйшыя, чым у спіртоў з тым самым лікам атамаў вугляроду.
H альдэгіднай групы з’яўляецца малапалярнай, таму дадатны зарад на атаме вадароду альдэгіднай групы недастатковы для ўтварэння вадароднай сувязі з атамам кіслароду суседняй малекулы. З прычыны гэтага тэмпературы кіпення альдэгідаў ніжэйшыя, чым у спіртоў з тым самым лікам атамаў вугляроду.
Найпрасцейшыя альдэгіды — метаналь, этаналь і прапаналь — добра раствараюцца ў вадзе. З павелічэннем памеру вуглевадароднага радыкала растваральнасць у вадзе памяншаецца.

з водарамі альдэгідаў
Цікава ведаць
Альдэгіды, малекулы якіх змяшчаюць неразгалінаваны ланцуг з 8–12 атамаў вугляроду маюць прыемныя пахі пры моцным разбаўленні (у чыстым выглядзе — вельмі рэзкія) і ўваходзяць у састаў вядомых парфумерных кампазіцый. Дакладны састаў гэтых кампазіцый з’яўляецца камерцыйнай тайнай, вядома толькі, што духі Chanel № 5, Lancome Climat, Givenchy L′Interdit змяшчаюць актаналь (C8H16O), нананаль (C9H18O), лаўрынавы альдэгід (C12H24O) (мал. 29.2).
Мы пазнаёміліся з арганічнымі злучэннямі, малекулы якіх змяшчаюць карбанільную групу — альдэгідамі і кетонамі. У наступным параграфе разгледзім хімічныя ўласцівасці альдэгідаў, іх атрыманне і прымяненне.
Альдэгіды — арганічныя злучэнні, малекулы якіх змяшчаюць альдэгідную групу, злучаную з атамам вадароду або вуглевадародным радыкалам.
Агульная формула гамолагаў воцатнага альдэгіду СnH2n+1 ![]() CHO.
CHO.
Назвы альдэгідаў утвараюцца шляхам дабаўлення суфікса -аль, які азначае альдэгідную групу, да назвы адпаведнага алкану.
Тэмпературы кіпення альдэгідаў ніжэйшыя, чым у спіртоў, з прычыны немагчымасці ўтварэння вадародных сувязей паміж іх малекуламі.