§ 29. Альдэгіды. Наменклатура. Ізамерыя. Фізічныя ўласцівасці
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | § 29. Альдэгіды. Наменклатура. Ізамерыя. Фізічныя ўласцівасці |
| Напечатано:: | Гость |
| Дата: | Monday, 13 October 2025, 18:45 |
Будова альдэгіднай групы
Вы ўжо ведаеце, што атамы кіслароду ў малекулах арганічных злучэнняў могуць выступаць у якасці «масткоў» паміж алкільным радыкалам і атамам вадароду (спірты):
![]()
або паміж дзвюма алкільнымі групамі (простыя эфіры):
![]()
Акрамя таго, атам кіслароду можа быць звязаны з атамам вугляроду двайной сувяззю:

Дадзеная формула адлюстроўвае будову новай функцыянальнай групы, якая ўваходзіць у састаў мноства арганічных злучэнняў. Гэта група называецца карбанільнай групай.
Як бачна, атам вугляроду карбанільнай групы ўтварае дзве сувязі з атамам кіслароду. Дзве астатнія сувязі атам вугляроду можа ўтвараць з вуглевадароднымі радыкаламі:

Такія арганічныя злучэнні адносяцца да класа кетонаў.
Вуглевадародныя радыкалы ў малекулах кетонаў могуць быць як аднолькавымі, так і рознымі. У малекуле найпрасцейшага кетону абодва радыкалы — метыльныя групы. Гэты кетон называецца ацэтонам:

Ацэтон уяўляе сабой лёгкакіпячую вадкасць (tкіп = 56 °С) з характэрным пахам, якая неабмежавана змешваецца з вадой. Выкарыстоўваецца ў якасці растваральніка і ў арганічным сінтэзе.
Цікава ведаць
Яшчэ адзін вядомы кетон — кетон маліны — таксама мае ў саставе малекулы карбанільную групу. Гэта злучэнне больш складанай будовы:

Кетон маліны змяшчаецца, натуральна, у маліне, што абумоўлівае яе характэрны пах. Сінтэтычны кетон маліны прымяняецца ў якасці дабаўкі да харчовых прадуктаў і касметычных сродкаў.
Калі злучыць карбанільную групу з атамам вадароду, то атрымаецца альдэгідная група:

Злучэнні, якія змяшчаюць альдэгідную групу, адносяцца да класа альдэгідаў. У малекуле найпрасцейшага прадстаўніка гэтага класа злучэнняў альдэгідная група звязана з атамам вадароду:

Гэта злучэнне называецца мурашыным альдэгідам або фармальдэгідам, і ўяўляе сабой бясколерны ядавіты газ з рэзкім пахам, які добра раствараецца ў вадзе. 40%-ны водны раствор фармальдэгіду называецца фармалін і выкарыстоўваецца для кансервацыі біялагічных прэпаратаў.
Атам вугляроду альдэгіднай групы знаходзіцца ў стане sp2-гібрыдызацыі. З адной s- і двух p-арбіталей фарміруюцца тры гібрыдныя арбіталі, за кошт якіх атам вугляроду ўтварае тры σ-сувязі. Негібрыдная р-арбіталь атама вугляроду ўдзельнічае ва ўтварэнні π-сувязі з атамам кіслароду:

Малекула фармальдэгіду плоская, валентныя вуглы блізкія да 120°. Шарастрыжнёвая мадэль малекулы фармальдэгіду:

У малекуле бліжэйшага гамолага фармальдэгіду альдэгідная група звязана з метыльным радыкалам:

Назва гэтага злучэння — воцатны альдэгід або ацэтальдэгід. Воцатны альдэгід пры н. у. уяўляе сабой бясколерную вадкасць з пахам яблыкаў. Тэмпература кіпення воцатнага альдэгіду 21 °С.
Шарастрыжнёвая мадэль малекулы воцатнага альдэгіду:

Наяўнасць групы  (або
(або ![]() CHO) у малекулах альдэгідаў абумоўлівае іх характэрныя хімічныя ўласцівасці. Таму альдэгідную групу называюць функцыянальнай групай. Такім чынам, альдэгіды — арганічныя злучэнні, у малекулах якіх змяшчаецца група
CHO) у малекулах альдэгідаў абумоўлівае іх характэрныя хімічныя ўласцівасці. Таму альдэгідную групу называюць функцыянальнай групай. Такім чынам, альдэгіды — арганічныя злучэнні, у малекулах якіх змяшчаецца група ![]() CHO, злучаная з атамам вадароду або вуглевадародным радыкалам.
CHO, злучаная з атамам вадароду або вуглевадародным радыкалам.
Саставім агульную формулу гамолагаў воцатнага альдэгіду. У малекулах такіх альдэгідаў група ![]() CHO злучана з алкільным радыкалам ці вадародам. Як вы ўжо ведаеце, алкільны радыкал утвараецца ў выніку адрыву ад малекулы алкану аднаго атама вадароду. Агульная формула алкільных радыкалаў CnH2n+1
CHO злучана з алкільным радыкалам ці вадародам. Як вы ўжо ведаеце, алкільны радыкал утвараецца ў выніку адрыву ад малекулы алкану аднаго атама вадароду. Агульная формула алкільных радыкалаў CnH2n+1 ![]() . Тады агульная формула гамолагаў воцатнага альдэгіду:
. Тады агульная формула гамолагаў воцатнага альдэгіду:

Звярніце ўвагу, што для мурашынага альдэгіду n = 0.
Ізамерыя альдэгідаў
Для альдэгідаў магчыма ізамерыя вугляроднага шкілета. Гэты від ізамерыі з’яўляецца пачынаючы з рэчыва, якое змяшчае чатыры атамы вугляроду ў малекуле:

Так як альдэгідная група заўсёды размяшчаецца ў пачатку малекулы, то ізамерыя, звязаная са становішчам альдэгіднай групы, немагчыма. Аднак альдэгіды могуць быць ізамерны кетонам:

Лёгка пераканацца, што абодва прыведзеныя рэчывы маюць аднолькавую малекулярную формулу C3H6O, гэта значыць, з’яўляюцца ізамерамі.
Наменклатура альдэгідаў
Мурашыны альдэгід і воцатны альдэгід — трывіяльныя назвы, гэта значыць назвы, якія гістарычна склаліся. Па сістэматычнай наменклатуры назвы альдэгідаў утвараюцца шляхам дабаўлення суфікса -аль, які абазначае альдэгідную групу. Нумарацыю атамаў вугляроду галоўнага ланцуга заўсёды пачынаюць з атама вугляроду альдэгіднай групы.
Назавём усе ўпамянутыя вышэй альдэгіды:

Разгледзім больш складаны выпадак. Назавём альдэгід наступнай будовы:

Галоўны ланцуг складаецца з шасці атамаў вугляроду. Адпаведны алкан называецца гексан. Трэці, чацвёрты і пяты атамы вугляроду галоўнага ланцуга связаны з алкільнымі радыкаламі, назвы якіх пералічваюцца ў алфавітным парадку. Прыналежнасць злучэння да класа альдэгідаў указваем пры дапамозе суфікса -аль. Тады назва альдэгіду — 4,5-дыметыл-3-этылгексаналь.
Фізічныя ўласцівасці альдэгідаў
У табліцы 29.1 прыведзены формулы, назвы і тэмпературы кіпення некаторых альдэгідаў.
| Формула | Назва | tкіп, °С |
| H |
метаналь | –20 |
| CH3 |
этаналь | 21 |
| CH3 |
прапаналь | 49 |
| CH3 |
бутаналь | 76 |
| CH3 |
пентаналь | 103 |
Як відаць з табліцы, тэмпературы кіпення альдэгідаў значна ніжэйшыя, чым спіртоў з такім самым лікам атамаў вугляроду ў малекуле. Так, тэмпература кіпення метанолу роўная +65 °С, а метаналю –20 °С. Гэта сведчыць аб тым, што ўзаемадзеянне паміж малекуламі альдэгідаў слабейшае, чым паміж малекуламі спіртоў.
Нагадаем, што прычынай высокіх тэмператур кіпення спіртоў з’яўляецца наяўнасць паміж іх малекуламі вадародных сувязей. Вадародныя сувязі дастаткова моцна ўтрымліваюць малекулы спіртоў адну каля адной і робяць цяжкім пераход у газападобны стан. Паміж малекуламі альдэгідаў, у адрозненне ад спіртоў, вадародныя сувязі не ўтвараюцца, так як у альдэгідах адсутнічаюць атамы вадароду, звязаныя з атамам кіслароду.
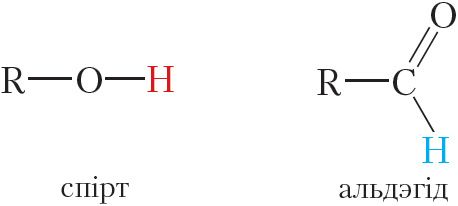
Сувязь C ![]() H альдэгіднай групы з’яўляецца малапалярнай, таму дадатны зарад на атаме вадароду альдэгіднай групы недастатковы для ўтварэння вадароднай сувязі з атамам кіслароду суседняй малекулы. З прычыны гэтага тэмпературы кіпення альдэгідаў ніжэйшыя, чым у спіртоў з тым самым лікам атамаў вугляроду.
H альдэгіднай групы з’яўляецца малапалярнай, таму дадатны зарад на атаме вадароду альдэгіднай групы недастатковы для ўтварэння вадароднай сувязі з атамам кіслароду суседняй малекулы. З прычыны гэтага тэмпературы кіпення альдэгідаў ніжэйшыя, чым у спіртоў з тым самым лікам атамаў вугляроду.
Найпрасцейшыя альдэгіды — метаналь, этаналь і прапаналь — добра раствараюцца ў вадзе. З павелічэннем памеру вуглевадароднага радыкала растваральнасць у вадзе памяншаецца.

з водарамі альдэгідаў
Цікава ведаць
Альдэгіды, малекулы якіх змяшчаюць неразгалінаваны ланцуг з 8–12 атамаў вугляроду маюць прыемныя пахі пры моцным разбаўленні (у чыстым выглядзе — вельмі рэзкія) і ўваходзяць у састаў вядомых парфумерных кампазіцый. Дакладны састаў гэтых кампазіцый з’яўляецца камерцыйнай тайнай, вядома толькі, што духі Chanel № 5, Lancome Climat, Givenchy L′Interdit змяшчаюць актаналь (C8H16O), нананаль (C9H18O), лаўрынавы альдэгід (C12H24O) (мал. 29.2).
Мы пазнаёміліся з арганічнымі злучэннямі, малекулы якіх змяшчаюць карбанільную групу — альдэгідамі і кетонамі. У наступным параграфе разгледзім хімічныя ўласцівасці альдэгідаў, іх атрыманне і прымяненне.
Альдэгіды — арганічныя злучэнні, малекулы якіх змяшчаюць альдэгідную групу, злучаную з атамам вадароду або вуглевадародным радыкалам.
Агульная формула гамолагаў воцатнага альдэгіду СnH2n+1 ![]() CHO.
CHO.
Назвы альдэгідаў утвараюцца шляхам дабаўлення суфікса -аль, які азначае альдэгідную групу, да назвы адпаведнага алкану.
Тэмпературы кіпення альдэгідаў ніжэйшыя, чым у спіртоў, з прычыны немагчымасці ўтварэння вадародных сувязей паміж іх малекуламі.
Пытанні і заданні
1. Прывядзіце структурную формулу мурашынага альдэгіду. Колькі σ- і π-сувязей у малекуле гэтага альдэгіду?
2. Напішыце структурную формулу найпрасцейшага кетону. Як называецца гэта злучэнне? Дзе вы з ім сустракаецеся ў побыце? Напішыце структурную формулу кетону, які змяшчае чатыры атамы вугляроду ў малекуле.
3. Напішыце структурныя формулы ўсіх ізамерных альдэгідаў саставу C4H9 ![]() CHO і дайце ім назвы.
CHO і дайце ім назвы.
4. Назавіце альдэгід наступнай будовы:

5. Чым тлумачыцца павышэнне тэмпературы кіпення ў радзе рэчываў: метаналь, этаналь, прапаналь?
6. Чаму тэмпература кіпення этаналю (21 °С) значна ніжэй, чым тэмпература кіпення этанолу (78 °С)?
7*. Адносная шчыльнасць пары альдэгіду па паветры роўная 2. Устанавіце формулу альдэгіду.