§ 23. Фізічныя ўласцівасці спіртоў. Вадародная сувязь і яе ўплыў на ўласцівасці спіртоў
Растваральнасць спіртоў у вадзе
Разглядаючы растваральнасць спіртоў, зноў успомнім прынцып «падобнае раствараецца ў падобным». У адрозненне ад вуглевадародаў, у малекулах спіртоў маецца палярная група ![]() OH. Палярная група
OH. Палярная група ![]() OH надае спіртам растваральнасць у вадзе, малекулы якой з’яўляюцца палярнымі. Вуглевадародны радыкал, насупраць, «перашкаджае» спіртам растварацца ў вадзе:
OH надае спіртам растваральнасць у вадзе, малекулы якой з’яўляюцца палярнымі. Вуглевадародны радыкал, насупраць, «перашкаджае» спіртам растварацца ў вадзе:
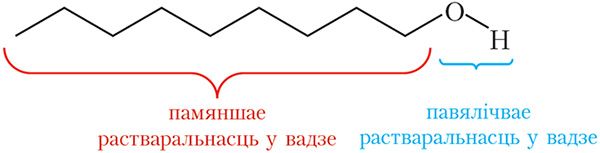
на здольнасць спіртоў растварацца ў вадзе
Сапраўды, метанол, этанол і ізамерныя прапанолы змешваюцца з вадой у любых суадносінах, з павелічэннем ліку атамаў вугляроду ў малекуле спірту растваральнасць у вадзе памяншаецца.
Як бачна, наяўнасць гідраксільных груп у малекулах спіртоў надае гэтым рэчывам уласцівасці, якія адрозніваюцца ад уласцівасцей вуглевадародаў. Спірты маюць высокія тэмпературы кіпення, ніжэйшыя спірты добра раствараюцца ў вадзе. Хімічныя ўласцівасці спіртоў таксама маюць рад асаблівасцей, пра гэта пойдзе гаворка ў наступным параграфе.
Пры пераходзе рэчыва з вадкага стану ў газападобны пераадольваюцца сілы міжмалекулярнага ўзаемадзеяння. Таму чым мацнейшае ўзаемадзеянне паміж малекуламі рэчыва, тым вышэйшая яго тэмпература кіпення.
Асобным відам міжмалекулярнага ўзаемадзеяння з’яўляецца вадародная сувязь.
Дзякуючы наяўнасці палярных груп ![]() OH паміж малекуламі спіртоў утвараюцца вадародныя сувязі, таму тэмпературы кіпення спіртоў намнога вышэйшыя, чым тэмпературы кіпення алканаў з такім самым лікам атамаў вугляроду ў малекулах.
OH паміж малекуламі спіртоў утвараюцца вадародныя сувязі, таму тэмпературы кіпення спіртоў намнога вышэйшыя, чым тэмпературы кіпення алканаў з такім самым лікам атамаў вугляроду ў малекулах.
Палярная група ![]() OH надае спіртам растваральнасць у вадзе. Метанол, этанол і ізамерныя прапанолы неабмежавана растваральны ў вадзе, з павелічэннем ліку атамаў вугляроду ў малекуле спірту растваральнасць у вадзе памяншаецца.
OH надае спіртам растваральнасць у вадзе. Метанол, этанол і ізамерныя прапанолы неабмежавана растваральны ў вадзе, з павелічэннем ліку атамаў вугляроду ў малекуле спірту растваральнасць у вадзе памяншаецца.