§ 23. Фізічныя ўласцівасці спіртоў. Вадародная сувязь і яе ўплыў на ўласцівасці спіртоў
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | § 23. Фізічныя ўласцівасці спіртоў. Вадародная сувязь і яе ўплыў на ўласцівасці спіртоў |
| Напечатано:: | Гость |
| Дата: | Суббота, 31 Май 2025, 18:48 |
Фізічныя ўласцівасці спіртоў. Вадародная сувязь і яе ўплыў на ўласцівасці спіртоў
Пры звычайных умовах спірты ўяўляюць сабой бясколерныя вадкасці з характэрным пахам. Вышэйшыя спірты, малекулы якіх змяшчаюць вялікі лік атамаў вугляроду, — цвёрдыя рэчывы, падобныя на парафін.
Цікава ведаць
Многія спірты выяўлены ў прыродных аб’ектах. Так, вядомае пустазелле баршчэўнік змяшчае метанол; да класа спіртоў адносіцца халестэрын, які пры няправільным харчаванні адкладваецца на сценках сасудаў і перашкаджае крывацёку. Разам з тым многія спірты маюць прыемны пах, напрыклад ментол, які змяшчаецца ў лістах, сцёблах і каранях мяты:

У табліцы 23.1 прыведзены структурныя формулы, назвы і тэмпературы кіпення насычаных аднаатамных спіртоў.
| Формула | Назва | tкіп, °C |
| СН3 |
метанол | 65 |
| СН3 |
этанол | 78 |
| CH3 |
прапанол-1 | 97 |
| CH3 |
бутанол-1 | 118 |
| CH3 |
пентанол-1 | 138 |
Міжмалекулярнае ўзаемадзеянне і вадародная сувязь
З табліцы 23.1 відаць, што ў адрозненне ад вуглевадародаў у гамалагічным радзе насычаных аднаатамных спіртоў адсутнічаюць газападобныя рэчывы. Нават найпрасцейшы спірт — метанол — пры звычайных умовах вадкасць з тэмпературай кіпення 65 °С.
Вывучаючы фізічныя ўласцівасці алканаў (§ 8), мы бачылі, што іх тэмпературы кіпення растуць з павелічэннем памераў малекул. На малюнку 23.2 адлюстраваны шарастрыжнёвыя мадэлі малекул метану, этану, прапану і ўказаны іх тэмпературы кіпення:
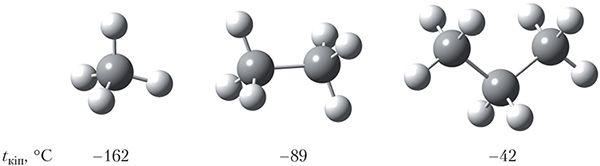
Памеры малекул этану і метанолу блізкія, таму можна было б чакаць, што гэтыя рэчывы будуць мець блізкія тэмпературы кіпення. Тым не менш, тэмпературы кіпення этану і метанолу адрозніваюцца больш чым на 150 °С і складаюць –89 і +65 °С адпаведна:
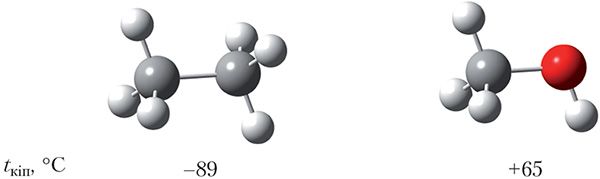
У чым жа прычына анамальна высокіх тэмператур кіпення спіртоў? Тлумачэнне гэтай з’явы заключаецца ў наступным. Малекулы вадкасці знаходзяцца блізка адна да адной. Гэта магчыма дзякуючы таму, што малекулы прыцягваюцца, значыць, існуюць сілы, якія ўтрымліваюць малекулы вадкасці разам. З курса хіміі 8-га класа вы ведаеце, што гэтыя сілы называюцца сіламі міжмалекулярнага ўзаемадзеяння. Каб ператварыць вадкасць у газ, неабходна пераадолець сілы міжмалекулярнага ўзаемадзеяння:

Відавочна, што чым мацнейшае узаемадзеянне паміж малекуламі рэчыва, тым вышэйшая яго тэмпература кіпення.
Сілы міжмалекулярнага ўзаемадзеяння маюць электрастатычную прыроду. Вельмі слабым будзе ўзаемадзеянне паміж малекуламі, якія маюць малыя памеры і на атамах якіх адсутнічаюць частковыя электрычныя зарады, гэта значыць паміж маленькімі непалярнымі малекуламі.
Прыклад.. Тэмпературы кіпення азоту N2 і кіслароду O2 вельмі нізкія і роўныя –196 і –183 °С адпаведна. Гэта тлумачыцца тым, што малекулы дадзеных рэчываў маюць малыя памеры, сувязі ў малекулах непалярныя, частковыя зарады на атамах адсутнічаюць, таму малекулы вельмі слаба прыцягваюцца адна да адной.
У радзе метан — этан — прапан з ростам памераў малекул павялічваецца плошча іх судакранання і, такім чынам, павялічваецца міжмалекулярнае ўзаемадзеянне (мал. 23.2). Таму ў гамалагічным радзе алканаў па меры павелічэння колькасці атамаў вугляроду ў малекуле растуць тэмпературы кіпення.
Міжмалекулярнае ўзаемадзеянне ўзмацняецца пры з’яўленні ў малекуле палярных сувязей. У малекулах з кавалентнымі палярнымі сувязямі электронная шчыльнасць размеркавана нераўнамерна. Напрыклад, у малекуле хлоравадароду HCl агульная электронная пара зрушана да больш электраадмоўнага атама хлору. У выніку на атаме хлору ўзнікае частковы адмоўны зарад, на атаме вадароду — частковы дадатны (§ 4).
![]()
Дзякуючы наяўнасці частковых зарадаў атам вадароду адной малекулы HCl будзе прыцягвацца да атама хлору другой малекулы:

Тэмпература кіпення хлоравадароду роўная –61 °С.
Яшчэ больш моцнае ўзаемадзеянне маецца паміж малекуламі спіртоў. Разгледзім гэта на прыкладзе метылавага спірту. Атам вадароду гідраксільнай групы ![]() О
О ![]() Н малекулы метанолу ўтварае з атамам кіслароду моцнапалярную сувязь. Гэта тлумачыцца тым, што кісларод — адзін з самых электраадмоўных элементаў, уступае па электраадмоўнасці толькі фтору. Такім чынам, атам вадароду, злучаючыся з кіслародам, практычна пазбаўляецца свайго электроннага воблака. Валодаючы малымі памерамі і, у адрозненне ад іншых атамаў не маючы ўнутраных электронных слаёў, такі атам вадароду здольны пранікаць у электронныя абалонкі атамаў іншых малекул. У выніку паміж малекуламі метанолу ўзнікае асаблівы тып міжмалекулярнага ўзаемадзеяння — вадародная сувязь:
Н малекулы метанолу ўтварае з атамам кіслароду моцнапалярную сувязь. Гэта тлумачыцца тым, што кісларод — адзін з самых электраадмоўных элементаў, уступае па электраадмоўнасці толькі фтору. Такім чынам, атам вадароду, злучаючыся з кіслародам, практычна пазбаўляецца свайго электроннага воблака. Валодаючы малымі памерамі і, у адрозненне ад іншых атамаў не маючы ўнутраных электронных слаёў, такі атам вадароду здольны пранікаць у электронныя абалонкі атамаў іншых малекул. У выніку паміж малекуламі метанолу ўзнікае асаблівы тып міжмалекулярнага ўзаемадзеяння — вадародная сувязь:
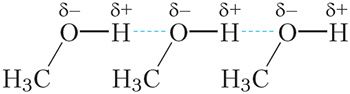
Вадародную сувязь прынята абазначаць пункцірнай лініяй. Вадародныя сувязі дастаткова моцна ўтрымліваюць малекулы метанолу адну каля адной, таму тэмпература кіпення метанолу (+65 °С) значна вышэй тэмпературы кіпення этану (–89 °C), паміж малекуламі якога вадародныя сувязі адсутнічаюць, нягледзячы на тое, што памеры малекул гэтых рэчываў блізкія.
Энергія вадароднай сувязі прыкладна ў 10 разоў менш, чым энергія кавалентнай сувязі, таму вадародную сувязь не прынята лічыць асобным тыпам хімічнай сувязі. Гэта асаблівы від моцнага міжмалекулярнага ўзаемадзеяння.
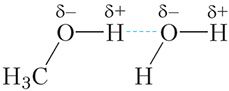
Малекулы спіртоў утвараюць вадародныя сувязі не толькі паміж сабой, але і з малекуламі вады (мал. 23.7).
Растваральнасць спіртоў у вадзе
Разглядаючы растваральнасць спіртоў, зноў успомнім прынцып «падобнае раствараецца ў падобным». У адрозненне ад вуглевадародаў, у малекулах спіртоў маецца палярная група ![]() OH. Палярная група
OH. Палярная група ![]() OH надае спіртам растваральнасць у вадзе, малекулы якой з’яўляюцца палярнымі. Вуглевадародны радыкал, насупраць, «перашкаджае» спіртам растварацца ў вадзе:
OH надае спіртам растваральнасць у вадзе, малекулы якой з’яўляюцца палярнымі. Вуглевадародны радыкал, насупраць, «перашкаджае» спіртам растварацца ў вадзе:
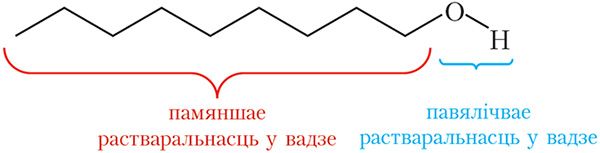
на здольнасць спіртоў растварацца ў вадзе
Сапраўды, метанол, этанол і ізамерныя прапанолы змешваюцца з вадой у любых суадносінах, з павелічэннем ліку атамаў вугляроду ў малекуле спірту растваральнасць у вадзе памяншаецца.
Як бачна, наяўнасць гідраксільных груп у малекулах спіртоў надае гэтым рэчывам уласцівасці, якія адрозніваюцца ад уласцівасцей вуглевадародаў. Спірты маюць высокія тэмпературы кіпення, ніжэйшыя спірты добра раствараюцца ў вадзе. Хімічныя ўласцівасці спіртоў таксама маюць рад асаблівасцей, пра гэта пойдзе гаворка ў наступным параграфе.
Пры пераходзе рэчыва з вадкага стану ў газападобны пераадольваюцца сілы міжмалекулярнага ўзаемадзеяння. Таму чым мацнейшае ўзаемадзеянне паміж малекуламі рэчыва, тым вышэйшая яго тэмпература кіпення.
Асобным відам міжмалекулярнага ўзаемадзеяння з’яўляецца вадародная сувязь.
Дзякуючы наяўнасці палярных груп ![]() OH паміж малекуламі спіртоў утвараюцца вадародныя сувязі, таму тэмпературы кіпення спіртоў намнога вышэйшыя, чым тэмпературы кіпення алканаў з такім самым лікам атамаў вугляроду ў малекулах.
OH паміж малекуламі спіртоў утвараюцца вадародныя сувязі, таму тэмпературы кіпення спіртоў намнога вышэйшыя, чым тэмпературы кіпення алканаў з такім самым лікам атамаў вугляроду ў малекулах.
Палярная група ![]() OH надае спіртам растваральнасць у вадзе. Метанол, этанол і ізамерныя прапанолы неабмежавана растваральны ў вадзе, з павелічэннем ліку атамаў вугляроду ў малекуле спірту растваральнасць у вадзе памяншаецца.
OH надае спіртам растваральнасць у вадзе. Метанол, этанол і ізамерныя прапанолы неабмежавана растваральны ў вадзе, з павелічэннем ліку атамаў вугляроду ў малекуле спірту растваральнасць у вадзе памяншаецца.
Пытанні і заданні
1. Як наяўнасць гідраксільных груп у малекулах спіртоў адбіваецца на іх фізічных уласцівасцях?
2. Чаму тэмпературы кіпення спіртоў значна вышэйшыя, чым вуглевадародаў з такім самым лікам атамаў вугляроду ў малекуле?
3. Чаму тэмпература кіпення дыметылавага эфіру (–25 °С) намнога ніжэй, чым тэмпература кіпення этылавага спірту (78 °С)?
4. Чаму тэмпература кіпення расце ў радзе рэчываў: метанол, этанол, прапанол-1?
5. Растлумачце, чаму з ростам ліку атамаў вугляроду ў малекулах спіртоў іх растваральнасць у вадзе памяншаецца.
6*. Адна малекула вады можа ўтварыць чатыры вадародныя сувязі. Колькі вадародных сувязей можа ўтварыць адна малекула метанолу?
6*. Адна малекула вады можа ўтварыць чатыры вадародныя сувязі. Колькі вадародных сувязей можа ўтварыць адна малекула метанолу?
7*. Малярную масу рэчываў, якія ўяўляюць сабой лёгкакіпячыя вадкасці, можна вымераць з дапамогай прыбора, паказанага на малюнку:
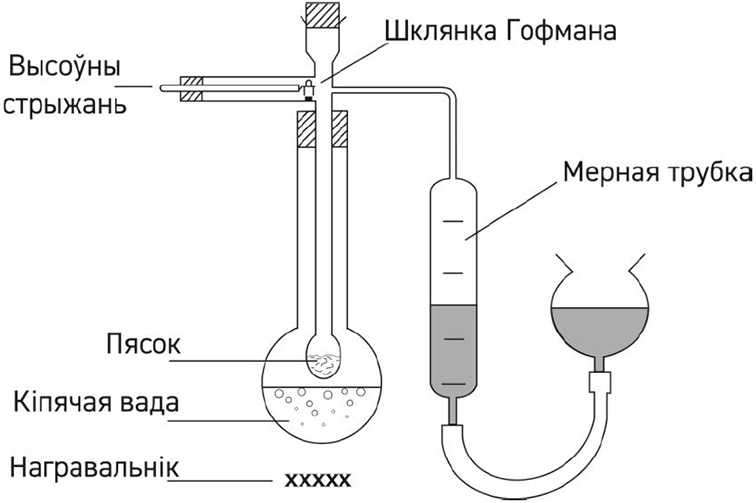
Для вызначэння малярнай масы невядомай вадкасці X 1,000 г яе змясцілі ў шклянку Гофмана. Пасля таго як пры дапамозе высоўнага стрыжня шклянка была скінута на нагрэты пясок і рэчыва X поўнасцю выпарылася, з мернай трубкі было выцеснена 760 мл вадкасці.
а) Па выніках апісанага эксперыменту разлічыце малярную масу рэчыва X, калі вядома, што шчыльнасць пентану, вымераная ва ўмовах доследу, роўная 2,554 г/дм3.
б) Значэнне малярнай масы рэчыва X, вызначанае іншымі метадамі, роўна 32 г/моль. Устаноўлена, што памылка пры вызначэнні малярнай масы ў апісаным эксперыменце абумоўлена тым, што ў пáры рэчыва X часткова дымерызавана. Выкарыстоўваючы правільнае значэнне малярнай масы і вынікі, атрыманыя ў п. а), разлічыце, колькі малекул X2 прыпадае на кожныя 100 малекул Х у пары.
в) Прапануйце магчымую структуру рэчыва Х і растлумачце прычыну яго дымерызацыі.
(Адказ:
а) M = m/n = 1,47/0,0396 = 37,1 г/моль.
б) На 100 малекул манамеру прыходзіцца 18,6 або 19 малекул дымеру.
в) Рэчывам Х з’яўляецца метанол, які часткова дымерызаваны ў пары за кошт утварэння вадародных сувязей паміж малекуламі.)