§ 23. Фізічныя ўласцівасці спіртоў. Вадародная сувязь і яе ўплыў на ўласцівасці спіртоў
Міжмалекулярнае ўзаемадзеянне і вадародная сувязь
З табліцы 23.1 відаць, што ў адрозненне ад вуглевадародаў у гамалагічным радзе насычаных аднаатамных спіртоў адсутнічаюць газападобныя рэчывы. Нават найпрасцейшы спірт — метанол — пры звычайных умовах вадкасць з тэмпературай кіпення 65 °С.
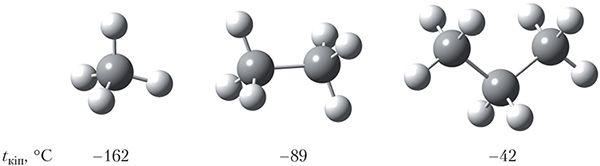
Вывучаючы фізічныя ўласцівасці алканаў (§ 8), мы бачылі, што іх тэмпературы кіпення растуць з павелічэннем памераў малекул. На малюнку 23.2 адлюстраваны шарастрыжнёвыя мадэлі малекул метану, этану, прапану і ўказаны іх тэмпературы кіпення:
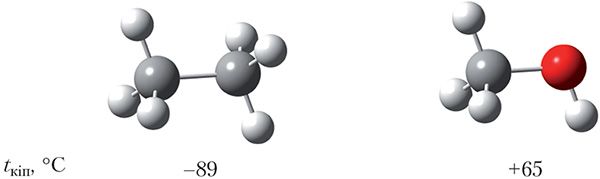
Памеры малекул этану і метанолу блізкія, таму можна было б чакаць, што гэтыя рэчывы будуць мець блізкія тэмпературы кіпення. Тым не менш, тэмпературы кіпення этану і метанолу адрозніваюцца больш чым на 150 °С і складаюць –89 і +65 °С адпаведна:
У чым жа прычына анамальна высокіх тэмператур кіпення спіртоў? Тлумачэнне гэтай з’явы заключаецца ў наступным. Малекулы вадкасці знаходзяцца блізка адна да адной. Гэта магчыма дзякуючы таму, што малекулы прыцягваюцца, значыць, існуюць сілы, якія ўтрымліваюць малекулы вадкасці разам. З курса хіміі 8-га класа вы ведаеце, што гэтыя сілы называюцца сіламі міжмалекулярнага ўзаемадзеяння. Каб ператварыць вадкасць у газ, неабходна пераадолець сілы міжмалекулярнага ўзаемадзеяння:

Відавочна, што чым мацнейшае узаемадзеянне паміж малекуламі рэчыва, тым вышэйшая яго тэмпература кіпення.
Сілы міжмалекулярнага ўзаемадзеяння маюць электрастатычную прыроду. Вельмі слабым будзе ўзаемадзеянне паміж малекуламі, якія маюць малыя памеры і на атамах якіх адсутнічаюць частковыя электрычныя зарады, гэта значыць паміж маленькімі непалярнымі малекуламі.
Прыклад.. Тэмпературы кіпення азоту N2 і кіслароду O2 вельмі нізкія і роўныя –196 і –183 °С адпаведна. Гэта тлумачыцца тым, што малекулы дадзеных рэчываў маюць малыя памеры, сувязі ў малекулах непалярныя, частковыя зарады на атамах адсутнічаюць, таму малекулы вельмі слаба прыцягваюцца адна да адной.
У радзе метан — этан — прапан з ростам памераў малекул павялічваецца плошча іх судакранання і, такім чынам, павялічваецца міжмалекулярнае ўзаемадзеянне (мал. 23.2). Таму ў гамалагічным радзе алканаў па меры павелічэння колькасці атамаў вугляроду ў малекуле растуць тэмпературы кіпення.
Міжмалекулярнае ўзаемадзеянне ўзмацняецца пры з’яўленні ў малекуле палярных сувязей. У малекулах з кавалентнымі палярнымі сувязямі электронная шчыльнасць размеркавана нераўнамерна. Напрыклад, у малекуле хлоравадароду HCl агульная электронная пара зрушана да больш электраадмоўнага атама хлору. У выніку на атаме хлору ўзнікае частковы адмоўны зарад, на атаме вадароду — частковы дадатны (§ 4).
![]()
Дзякуючы наяўнасці частковых зарадаў атам вадароду адной малекулы HCl будзе прыцягвацца да атама хлору другой малекулы:

Тэмпература кіпення хлоравадароду роўная –61 °С.
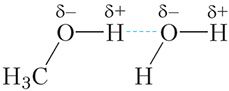
Яшчэ больш моцнае ўзаемадзеянне маецца паміж малекуламі спіртоў. Разгледзім гэта на прыкладзе метылавага спірту. Атам вадароду гідраксільнай групы ![]() О
О ![]() Н малекулы метанолу ўтварае з атамам кіслароду моцнапалярную сувязь. Гэта тлумачыцца тым, што кісларод — адзін з самых электраадмоўных элементаў, уступае па электраадмоўнасці толькі фтору. Такім чынам, атам вадароду, злучаючыся з кіслародам, практычна пазбаўляецца свайго электроннага воблака. Валодаючы малымі памерамі і, у адрозненне ад іншых атамаў не маючы ўнутраных электронных слаёў, такі атам вадароду здольны пранікаць у электронныя абалонкі атамаў іншых малекул. У выніку паміж малекуламі метанолу ўзнікае асаблівы тып міжмалекулярнага ўзаемадзеяння — вадародная сувязь:
Н малекулы метанолу ўтварае з атамам кіслароду моцнапалярную сувязь. Гэта тлумачыцца тым, што кісларод — адзін з самых электраадмоўных элементаў, уступае па электраадмоўнасці толькі фтору. Такім чынам, атам вадароду, злучаючыся з кіслародам, практычна пазбаўляецца свайго электроннага воблака. Валодаючы малымі памерамі і, у адрозненне ад іншых атамаў не маючы ўнутраных электронных слаёў, такі атам вадароду здольны пранікаць у электронныя абалонкі атамаў іншых малекул. У выніку паміж малекуламі метанолу ўзнікае асаблівы тып міжмалекулярнага ўзаемадзеяння — вадародная сувязь:
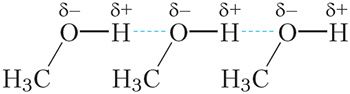
Вадародную сувязь прынята абазначаць пункцірнай лініяй. Вадародныя сувязі дастаткова моцна ўтрымліваюць малекулы метанолу адну каля адной, таму тэмпература кіпення метанолу (+65 °С) значна вышэй тэмпературы кіпення этану (–89 °C), паміж малекуламі якога вадародныя сувязі адсутнічаюць, нягледзячы на тое, што памеры малекул гэтых рэчываў блізкія.
Энергія вадароднай сувязі прыкладна ў 10 разоў менш, чым энергія кавалентнай сувязі, таму вадародную сувязь не прынята лічыць асобным тыпам хімічнай сувязі. Гэта асаблівы від моцнага міжмалекулярнага ўзаемадзеяння.
Малекулы спіртоў утвараюць вадародныя сувязі не толькі паміж сабой, але і з малекуламі вады (мал. 23.7).