§ 17. Алкадыены
Будова бутадыену-1,3
Усе чатыры атамы вугляроду ў малекуле бутадыену-1,3 знаходзяцца ў стане sp2-гібрыдызацыі. Тры гібрыдныя арбіталі кожнага атама вугляроду размяшчаюцца ў адной плоскасці пад вугламі 120°. Адпаведна, атамы ў малекуле бутадыену-1,3 таксама размяшчаюцца ў адной плоскасці, валентныя вуглы прыкладна роўныя 120°:
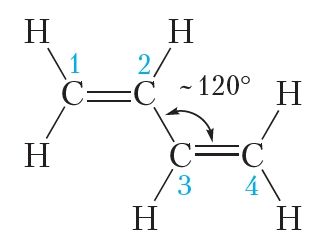
Негібрыдныя p-арбіталі кожнага атама вугляроду размяшчаюцца перпендыкулярна плоскасці малекулы. Пры перакрыванні негібрыдных p-арбіталей утвараюцца π-сувязі:

а — від збоку; б — від зверху
З малюнка 17.1, б відаць, што перакрыванне негібрыдных p-арбіталей адбываецца паміж звязанымі двайнымі сувязямі атамамі вугляроду C(1)![]() C(2) і C(3)
C(2) і C(3)![]() C(4). Але, акрамя таго, у дадзенай малекуле маецца перакрыванне p-арбіталей паміж другім і трэцім атамамі вугляроду. Такім чынам, π-сувязі ў малекуле бутадыену-1,3 не з’яўляюцца ізаляванымі, яны ўтвараюць адзіную спалучаную сістэму, якая ахоплівае ўсе чатыры атамы вугляроду. Іншымі словамі, π-электроны ў малекуле бутадыену не належаць асобным сувязям. У гэтым выпадку кажуць, што π-электроны дэлакалізаваны.
C(4). Але, акрамя таго, у дадзенай малекуле маецца перакрыванне p-арбіталей паміж другім і трэцім атамамі вугляроду. Такім чынам, π-сувязі ў малекуле бутадыену-1,3 не з’яўляюцца ізаляванымі, яны ўтвараюць адзіную спалучаную сістэму, якая ахоплівае ўсе чатыры атамы вугляроду. Іншымі словамі, π-электроны ў малекуле бутадыену не належаць асобным сувязям. У гэтым выпадку кажуць, што π-электроны дэлакалізаваны.
Спалучэнне прыводзіць да некаторага выраўноўвання даўжынь двайных і адзінарных сувязей у малекуле бутадыену-1,3.
З малюнка 17.2 відаць, што двайныя сувязі ў малекуле бутадыену-1,3 некалькі даўжэйшыя, чым у малекуле этылену, у той час як сувязь C(2)![]() C(3) у малекуле бутадыену-1,3 істотна карацейшая, чым у малекуле этану. Эфект спалучэння аказвае ўплыў і на хімічныя ўласцівасці дыенаў, пра якія пойдзе гаворка ніжэй.
C(3) у малекуле бутадыену-1,3 істотна карацейшая, чым у малекуле этану. Эфект спалучэння аказвае ўплыў і на хімічныя ўласцівасці дыенаў, пра якія пойдзе гаворка ніжэй.
