§ 8. Гамалагічны рад і фізічныя ўласцівасці алканаў
Гамалагічны рад і фізічныя ўласцівасці алканаў
З матэрыялу папярэдніх параграфаў вы пазнаёміліся з арганічнымі злучэннямі, якія адносяцца да класа алканаў. Алканы называюць таксама гранічнымі вуглевадародамі. Назва «гранічныя вуглевадароды» абумоўлена тым, што малекулы алканаў змяшчаюць гранічна магчымы лік атамаў вадароду.
Атамы вугляроду ў малекулах алканаў злучаны толькі адзінарнымі сувязямі. Такія рэчывы называюць насычанымі. У адрозненне ад насычаных вуглевадародаў, у малекулах ненасычаных злучэнняў маюцца атамы вугляроду, звязаныя двайнымі або трайнымі сувязямі. Прыклады ненасычаных вуглевадародаў:
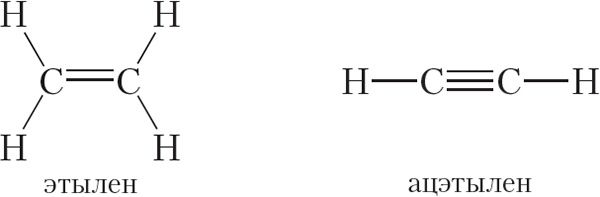
Ненасычаныя вуглевадароды мы будзем вывучаць пазней, пакуль засяродзім увагу на насычаных вуглевадародах — алканах.
Нягледзячы на тое, што мы пазнаёміліся толькі з некалькімі прадстаўнікамі алканаў, відавочна, што злучэнняў гэтага класа можа быць велізарная колькасць, як за кошт магчымасці ўтварэння вугляродных ланцугоў рознай даўжыні, так і за кошт ізамерыі. Састаў усіх алканаў апісваецца агульнай формулай CnH2n+2.
Відавочна, што састаў малекулы этану адрозніваецца ад саставу малекулы метану на адзін атам вугляроду і два атамы вадароду — СН2. Такую самую розніцу ў саставе маюць малекулы прапану і этану, н-бутану і прапану:
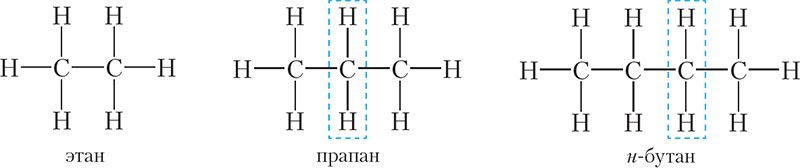
У той жа час састаў н-бутану і этану адрозніваецца на дзве групы СН2. Такім чынам, малекулы алканаў па саставе адрозніваюцца на адну або некалькі груп CH2. Пры гэтым малекулы алканаў маюць падобную будову: сувязі паміж атамамі вугляроду адзінарныя, астатнія сувязі вуглярод утварае з вадародам. Таму розныя алканы маюць падобныя хімічныя ўласцівасці.
Рэчывы, якія падобны па будове і хімічных уласцівасцях, але адрозніваюцца па саставе малекул на адну або некалькі груп СН2, называюцца гамолагамі і ўтвараюць гамалагічны рад.
Напрыклад, метан, этан і прапан з’яўляюцца гамолагамі.
Паняцце «гамалагічны рад» з’яўляецца важным у арганічнай хіміі. Улічваючы велізарнае мноства арганічных злучэнняў, вывучэнне хімічных уласцівасцей кожнага арганічнага рэчыва не ўяўляецца магчымым, таму падобныя па будове рэчывы аб’ядноўваюць у гамалагічныя рады і вывучаюць агульныя ўласцівасці, характэрныя для ўсіх прадстаўнікоў дадзенага гамалагічнага рада. Мы не будзем разглядаць асобна хімічныя ўласцівасці метану, потым уласцівасці этану і г. д. Замест гэтага вывучым уласцівасці, якія характэрны для ўсіх алканаў.
Разгледзім фізічныя ўласцівасці алканаў. У табліцы 8.1 прыведзены тэмпературы кіпення неразгалінаваных алканаў, малекулы якіх змяшчаюць ад аднаго да дзесяці атамаў вугляроду.
| Малекулярная формула | Структурная формула | Тэмпература кіпення (tкіп, °С) |
| СН4 | СН4 | –162 |
| С2Н6 | СН3—СН3 | –189 |
| С3Н8 | СН3—СН2—СН3 | –42 |
| С4Н10 | СН3—(СН2)2—СН3 | –0,5 |
| С5Н12 | СН3—(СН2)3—СН3 | 36 |
| С6Н14 | СН3—(СН2)4—СН3 | 69 |
| С7Н16 | СН3—(СН2)5—СН3 | 98 |
| С8Н18 | СН3—(СН2)6—СН3 | 126 |
| С9Н20 | СН3—(СН2)7—СН3 | 151 |
| С10Н22 | СН3—(СН2)8—СН3 | 174 |
З даных табліцы бачна, што тэмпературы кіпення метану, этану, прапану і н-бутану ніжэй за 0 °С, такім чынам, гэтыя рэчывы пры нармальных умовах павінны быць газападобнымі. Сапраўды, метан, этан, прапан і н-бутан пры пакаёвай тэмпературы з’яўляюцца бясколернымі газамі. Алканы з большым лікам атамаў вугляроду ў малекуле (ад 5 да 15) уяўляюць сабой вадкасці са спецыфічным пахам. Гэтыя алканы ўваходзяць у састаў бензіну, газы, многіх растваральнікаў. Алканы з яшчэ большым лікам атамаў вугляроду ў малекуле (ад 16 і больш) уяўляюць сабой цвёрдыя рэчывы. Яны добра знаёмыя вам — з цвёрдых алканаў вырабляюць парафінавыя свечкі. Назва парафіны (ад лац. parum — ‘мала’ і affinis — ‘які мае роднасць’) — яшчэ адна назва алканаў. Гэта назва ўказвае на нізкую хімічную актыўнасць алканаў, хімічныя ўласцівасці якіх будуць разгледжаны далей.
Алканы нерастваральны ў вадзе, але добра раствараюцца ў арганічных растваральніках. Успомніце правіла, вядомае вам з курса неарганічнай хіміі, — «падобнае раствараецца ў падобным». Гэта значыць, што добра змешваюцца паміж сабой рэчывы, якія маюць падобную будову. Напрыклад, вада, малекулы якой з’яўляюцца палярнымі, добра растварае рэчывы з іоннымі і кавалентнымі палярнымі сувязямі — кіслоты, шчолачы, солі. Наадварот, рэчывы, малекулы якіх утвораны кавалентнымі непалярнымі або малапалярнымі сувязямі, не раствараюцца ў вадзе, затое раствараюцца ў вадкасцях, якія складаюцца з непалярных малекул. Прывядзём прыклад: пляму ад машыннага масла на тканіне практычна немагчыма выдаліць з дапамогай вады, але яна можа быць з поспехам выдалена бензінам, паколькі машыннае масла і бензін складаюцца з рэчываў падобнай будовы, вуглевадародаў.
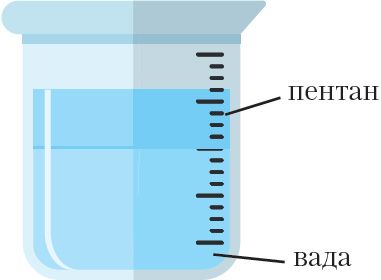
сумесі пентану з вадой
Вадкія і цвёрдыя алканы маюць шчыльнасць менш за 1 г/см3, гэта значыць менш за шчыльнасць вады. Калі змясціць у хімічную шклянку ваду, а потым дабавіць пентан, то атрыманая сумесь падзеліцца на два слаі, прычым пентан збярэцца ў верхняй частцы, а знізу будзе вада (мал. 8.1.).
Такі самы эфект назіраецца пры пападанні нафты ў ваду. Пры гэтым на паверхні вады ўтвараецца плёнка з нафты, што наносіць велізарную шкоду жывым арганізмам. Таму аварыі, звязаныя з разлівам нафты, асабліва небяспечныя для навакольнага асяроддзя.
Вуглевадароды, у малекулах якіх атамы вугляроду злучаны толькі адзінарнымі сувязямі, называюцца насычанымі.
Алканы з’яўляюцца насычанымі вуглевадародамі.
Алканы называюць таксама гранічнымі вуглевадародамі, паколькі малекулы алканаў змяшчаюць гранічна магчымы лік атамаў вадароду.
Малекулы алканаў маюць падобную будову і па саставе адрозніваюцца на адну або некалькі груп CH2.
Рэчывы, якія падобны па будове і хімічных уласцівасцях, але адрозніваюцца па саставе малекул на адну або некалькі груп СН2, называюцца гамолагамі і ўтвараюць гамалагічны рад.
У гамалагічным радзе алканаў па меры павелічэння ліку атамаў вугляроду ў малекуле растуць тэмпературы кіпення.
Алканы не раствараюцца ў вадзе, але раствараюцца ў арганічных растваральніках.