§ 5. Прадмет арганічнай хіміі. Тэорыя будовы арганічных рэчываў
Тэорыя будовы арганічных рэчываў
Тэорыя будовы арганічных рэчываў сфарміравалася ў другой палове XIX стагоддзя. Да гэтага часу былі атрыманы і даследаваны многія арганічныя злучэнні, устаноўлены іх якасны і колькасны састаў, апісаны ўласцівасці.
Так, у канцы XVIII — пачатку XIX стагоддзя былі вылучаны важнейшыя вуглевадароды (арганічныя рэчывы, якія складаюцца толькі з вугляроду і вадароду) і ўстаноўлены іх малекулярныя формулы. Аднак аказалася, што веданне малекулярных формул, якія адлюстроўваюць толькі састаў рэчыва, відавочна недастаткова для разумення будовы і ўласцівасцей арганічных злучэнняў. Прывядзём прыклады некаторых супярэчнасцей, якія заводзілі ў тупік вучоных першай паловы XIX стагоддзя.
Прыклад 1. Малекулярныя формулы найпрасцейшых вуглевадародаў метану, этану і прапану — CH4, C2H6 і C3H8 адпаведна.
Да сярэдзіны XIX стагоддзя Э. Франкландам ужо было прапанавана паняцце валентнасці атамаў, а А. Кекуле выказаў здагадку, што атамы вугляроду чатырохвалентныя. Калі сыходзіць з таго, што вадарод аднавалентны, то, разглядаючы прыведзеныя малекулярныя формулы, можна памылкова меркаваць, што толькі ў метане CH4 вуглярод мае валентнасць роўную чатыром, валентнасць вугляроду ў этане C2H6 павінна раўняцца тром, а ў прапане С3H8 вуглярод павінен мець дробную валентнасць.
Прыклад 2. Аднолькавую формулу C4H10 маюць два розныя рэчывы.

Аляксандр Міхайлавіч
Бутлераў (1828–1886)
Тэмпература кіпення аднаго з гэтых рэчываў роўная –0,5 °С, тады як тэмпература кіпення другога больш чым на 11 °С ніжэй і складае –12 °С.
Накапленне падобных невытлумачальных на той момант фактаў стала перадумовай стварэння новай тэорыі — тэорыі будовы арганічных злучэнняў. Яе асноўныя палажэнні ў сярэдзіне XIX стагоддзя сфармуляваў А. М. Бутлераў.
Да таго часу было вядома, што малекулы складаюцца з атамаў, але вучоныя яшчэ не надавалі значэння таму, як атамы размяшчаюцца ў малекуле, і лічылі, што пазнаць гэта немагчыма. А. М. Бутлераў выказаў меркаванне аб тым, што атамы ў малекуле злучаны ў пэўнай паслядоўнасці, якую можна ўстанавіць хімічнымі метадамі і адлюстраваць у структурнай формуле.
Сфармулюем важнейшыя палажэнні тэорыі будовы арганічных злучэнняў А. М. Бутлерава:
1. Атамы, якія ўваходзяць у састаў арганічных злучэнняў, звязаны адзін з адным у пэўнай паслядоўнасці ў адпаведнасці з іх валентнасцю.
2. Уласцівасці рэчыва залежаць не толькі ад таго, атамы якіх элементаў і ў якой колькасці ўваходзяць у састаў малекул, але і ад паслядоўнасці злучэння атамаў у малекулах.
Дадзеная тэорыя адкрыла шлях да шырокага распаўсюджвання структурных формул для адлюстравання будовы арганічных рэчываў.
Выкарыстаем палажэнні тэорыі А. М. Бутлерава для тлумачэння супярэчнасцей, апісаных у прыкладах 1 і 2.
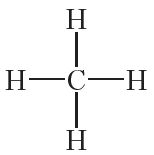
Спачатку растлумачым будову малекул найпрасцейшых вуглевадародаў. Улічваючы, што валентнасць вугляроду роўная чатыром, а валентнасць вадароду — адзінцы, структурная формула метану CH4 наступная:
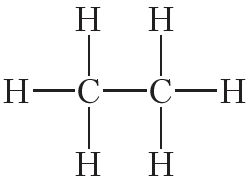
У малекуле этану C2H6 усе атамы вугляроду і вадароду ўваходзяць у састаў адной часціцы. Для гэтага два атамы вугляроду павінны ўтварыць паміж сабой хімічную сувязь. Астатнія тры адзінкі валентнасці кожны атам вугляроду выкарыстае для злучэння з трыма атамамі вадароду. Тады структурная формула этану:
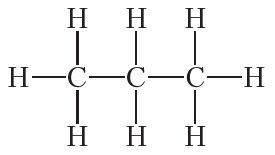
Аналагічныя разважанні для прапану C3H8 прыводзяць да структурнай формулы:
Як бачна, ва ўсіх гэтых вуглевадародах вуглярод чатырохвалентны.
Разгледзім цяпер, які ўплыў на ўласцівасці рэчываў аказвае паслядоўнасць звязвання атамаў у малекуле на прыкладзе злучэння з малекулярнай формулай C4H10. Можна скласці два ланцугі з чатырох атамаў вугляроду: лінейны і разгалінаваны:
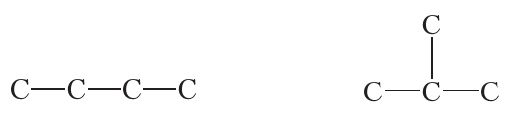
Такім чынам, малекулярную формулу C4H10 маюць два рэчывы:
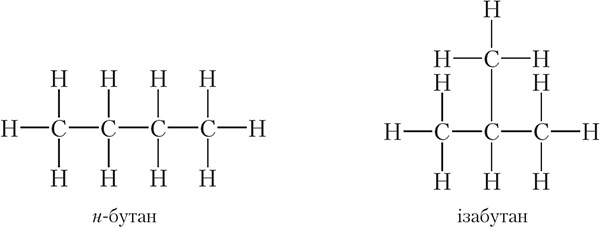
Так як н-бутан (н — скарочанае ад нармальны) і ізабутан з’яўляюцца рознымі рэчывамі, яны павінны мець розныя ўласцівасці. Сапраўды, тэмпература кіпення <em>н-бутану роўная –0,5 °С, тады як тэмпература кіпення ізабутану роўная –12 °С. Такім чынам, тэорыя Бутлерава дазволіла растлумачыць, чаму злучэнні, якія маюць зусім аднолькавы састаў, могуць валодаць рознымі ўласцівасцямі. Рэчывы, малекулы якіх маюць аднолькавы якасны і колькасны састаў, але розную будову, называюцца ізамерамі.
Далейшае развіццё навукі толькі дапаўняла і ўдасканальвала тэорыю А. М. Бутлерава, паказала яе справядлівасць не толькі для арганічных, але і для неарганічных злучэнняў. Структурныя формулы, упершыню прапанаваныя А. М. Бутлеравым, і сёння з поспехам выкарыстоўваюцца для адлюстравання будовы малекул як арганічных, так і неарганічных злучэнняў.
Значэнне гэтай тэорыі заключаецца ў сістэматызацыі велізарнага фактычнага матэрыялу, што дало магчымасць мэтанакіраванага сінтэзу новых рэчываў з зададзенымі ўласцівасцямі.
Арганічная хімія — хімія злучэнняў вугляроду.
Арганічныя злучэнні з’яўляюцца асновай жывых арганізмаў.
У аснове тэорыі будовы арганічных злучэнняў А. М. Бутлерава ляжаць уяўленні аб тым, што ўласцівасці рэчываў вызначаюцца не толькі іх саставам, але і паслядоўнасцю злучэння атамаў у малекуле.
Малекулы розных рэчываў могуць мець аднолькавы састаў, але розную паслядоўнасць злучэння атамаў у малекуле.