§ 5. Прадмет арганічнай хіміі. Тэорыя будовы арганічных рэчываў
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | § 5. Прадмет арганічнай хіміі. Тэорыя будовы арганічных рэчываў |
| Напечатано:: | Гость |
| Дата: | Суббота, 5 Июль 2025, 12:16 |
Прадмет арганічнай хіміі. Тэорыя будовы арганічных рэчываў
Вывучаючы неарганічную хімію, вы пазнаёміліся з рэчывамі самага разнастайнага саставу, многія з якіх з’яўляюцца асновай мінералаў, будаўнічых матэрыялаў, мінеральных угнаенняў, каштоўных камянёў і г. д. Пры гэтым вы не сустракалі, каб які-небудзь адзін хімічны элемент абавязкова прысутнічаў ва ўсіх неарганічных рэчывах. Адметнай асаблівасцю арганічных рэчываў з’яўляецца тое, што ў іх састаў, разам з іншымі элементамі, заўсёды ўваходзяць атамы вугляроду. Вывучэнне злучэнняў вугляроду — іх будовы, хімічных уласцівасцей, спосабаў атрымання — і складае прадмет арганічнай хіміі.
Арганічная хімія — хімія злучэнняў вугляроду.
Разам з вугляродам у састаў арганічных рэчываў часцей уваходзяць вадарод (CH4 — метан), кісларод (СH3COOH — воцатная кіслата) і азот (C6H5NH2 — анілін), радзей — галагены (CCl4 — тэтрахлорметан), сера (CH3SH — метылмеркаптан) і іншыя элементы. Адзначым, што некаторыя злучэнні вугляроду адносяцца да неарганічных рэчываў. Вы пазнаёміліся з імі раней. Гэта вуглякіслы газ (СО2), вугальная кіслата (Н2СО3), яе солі — карбанаты і некаторыя іншыя рэчывы.
Лік вядомых арганічных злучэнняў значна перавышае лік неарганічных злучэнняў. Такая разнастайнасць абумоўлена здольнасцю атамаў вугляроду злучацца адзін з адным з утварэннем ланцугоў і цыклаў, якія ўключаюць сотні і нават тысячы атамаў вугляроду.
Узнікненне арганічнай хіміі як навукі
Трэба адзначыць, што арганічныя рэчывы вядомы чалавецтву са старажытных часоў. Ужываючы параўнальна простыя спосабы перапрацоўкі раслін, людзі здаўна ўмелі атрымліваць трысняговы цукар, прыродныя фарбавальнікі, алей, воцат і г. д. Аднак навука аб злучэннях вугляроду ўзнікла толькі на пачатку XIX стагоддзя, пасля таго як хімікі навучыліся вызначаць састаў рэчываў і выражаць яго ў выглядзе малекулярных формул. Тады стала вядома, што рэчывы расліннага і жывёльнага паходжання змяшчаюць вуглярод.
У 1806 годзе шведскі хімік Я. Берцэліус прапанаваў называць рэчывы, якія атрымліваюць з жывых арганізмаў, арганічнымі, а навуку, якая вывучае іх, — арганічнай хіміяй. Наяўнасць вугляроду ў кожным арганічным рэчыве дазволіла Берцэліусу вызначыць арганічную хімію як хімію злучэнняў вугляроду. Такое азначэнне з’яўляецца агульнапрынятым і сёння. Разам з тым Берцэліус памылкова лічыў, што прынцыповым адрозненнем арганічных рэчываў ад неарганічных з’яўляецца тое, што першыя не могуць быць атрыманы ў лабараторыі, а ствараюцца толькі жывымі арганізмамі пад уплывам асаблівай «жыццёвай сілы». Тэорыя «жыццёвай сілы» атрымала назву «віталізм» (ад лац. vitalis — ‘жыццёвы’). Гэтай тэорыі неўзабаве быў нанесены сакрушальны ўдар, калі ў 1824 годзе з неарганічных рэчываў нямецкім хімікам Ф. Вёлерам была сінтэзавана шчаўевая кіслата, а ў 1828 годзе — мачавіна. У 1845 годзе была атрымана воцатная кіслата (А. Кольбэ, Германія), а ў 1854 годзе французскі хімік М. Бертло сінтэтычным шляхам атрымаў тлушчы. Сёння сінтэзаваны шматлікія арганічныя рэчывы, якія не толькі маюцца ў прыродзе, але і не сустракаюцца ў ёй, напрыклад, лекавыя прэпараты, пластмасы, сінтэтычныя каўчукі, вадкія крышталі і многія іншыя. Такім чынам, вучэнне аб «жыццёвай сіле» пацярпела поўнае паражэнне. Тым не менш, падзел хіміі на арганічную (хімію злучэнняў вугляроду) і неарганічную захаваўся і па сённяшні дзень.
Выяўленне вугляроду і вадароду ў саставе арганічных рэчываў
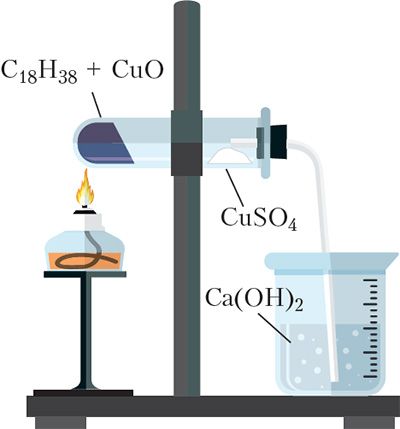
вугляроду і вадароду
ў саставе арганічнага рэчыва
(C18H38)
У састаў усіх арганічных рэчываў уваходзіць вуглярод. Большасць арганічных злучэнняў змяшчае таксама атамы вадароду. Доказам таго, што ў састаў арганічных злучэнняў уваходзяць вуглярод і вадарод, з’яўляецца наступны дослед.
У прабірку змяшчаюць аксід медзі(II) і парафін. Парафін уяўляе сабой сумесь цвёрдых вуглевадародаў (арганічных рэчываў, якія складаюцца з вугляроду і вадароду). Прабірку замацоўваюць гарызантальна ў лабараторным штатыве (мал. 5.1). На сценку прабіркі бліжэй да яе верхняй часткі асцярожна змяшчаюць бязводны сульфат медзі(II). Бязводны сульфат медзі(II) CuSO4 мае белы колер, у адрозненне ад блакітнага меднага купарвасу CuSO4 ∙ 5H2O. Закаркоўваюць прабірку коркам з газаадводнай трубкай, канец трубкі змяшчаюць у шклянку з празрыстай вапнавай вадой (водны раствор гідраксіду кальцыю Ca(OH)2). Прабірку награваюць у полымі спіртоўкі.
Аксід медзі(II) у дадзеным доследзе выступае ў ролі акісляльніка. Ён акісляе вуглевадароды да СO2 і вады, пры гэтым аксід медзі(II) аднаўляецца да медзі. Напрыклад, для вуглевадароду C18H38, які ўваходзіць у састаў парафіну, рэакцыю, якая працякае, можна адлюстраваць ураўненнем:
![]()
У ходзе эксперымента назіраюцца наступныя з’явы. На сценках прабіркі з’яўляюцца кропелькі вады, пры гэтым белы сульфат медзі(II) набывае блакітны колер, так як ператвараецца ў медны купарвас:
![]()
Вуглякіслы газ, які вылучаецца, выклікае памутненне вапнавай вады, так як утвараецца белы асадак CaCO3:
![]()
Астатак рэакцыйнай сумесі набывае чырвонае адценне з-за ўтварэння металічнай медзі. Такім чынам, гэты дослед даказвае наяўнасць вугляроду і вадароду ў малекулах арганічнага рэчыва.
Тэорыя будовы арганічных рэчываў
Тэорыя будовы арганічных рэчываў сфарміравалася ў другой палове XIX стагоддзя. Да гэтага часу былі атрыманы і даследаваны многія арганічныя злучэнні, устаноўлены іх якасны і колькасны састаў, апісаны ўласцівасці.
Так, у канцы XVIII — пачатку XIX стагоддзя былі вылучаны важнейшыя вуглевадароды (арганічныя рэчывы, якія складаюцца толькі з вугляроду і вадароду) і ўстаноўлены іх малекулярныя формулы. Аднак аказалася, што веданне малекулярных формул, якія адлюстроўваюць толькі састаў рэчыва, відавочна недастаткова для разумення будовы і ўласцівасцей арганічных злучэнняў. Прывядзём прыклады некаторых супярэчнасцей, якія заводзілі ў тупік вучоных першай паловы XIX стагоддзя.
Прыклад 1. Малекулярныя формулы найпрасцейшых вуглевадародаў метану, этану і прапану — CH4, C2H6 і C3H8 адпаведна.
Да сярэдзіны XIX стагоддзя Э. Франкландам ужо было прапанавана паняцце валентнасці атамаў, а А. Кекуле выказаў здагадку, што атамы вугляроду чатырохвалентныя. Калі сыходзіць з таго, што вадарод аднавалентны, то, разглядаючы прыведзеныя малекулярныя формулы, можна памылкова меркаваць, што толькі ў метане CH4 вуглярод мае валентнасць роўную чатыром, валентнасць вугляроду ў этане C2H6 павінна раўняцца тром, а ў прапане С3H8 вуглярод павінен мець дробную валентнасць.
Прыклад 2. Аднолькавую формулу C4H10 маюць два розныя рэчывы.

Аляксандр Міхайлавіч
Бутлераў (1828–1886)
Тэмпература кіпення аднаго з гэтых рэчываў роўная –0,5 °С, тады як тэмпература кіпення другога больш чым на 11 °С ніжэй і складае –12 °С.
Накапленне падобных невытлумачальных на той момант фактаў стала перадумовай стварэння новай тэорыі — тэорыі будовы арганічных злучэнняў. Яе асноўныя палажэнні ў сярэдзіне XIX стагоддзя сфармуляваў А. М. Бутлераў.
Да таго часу было вядома, што малекулы складаюцца з атамаў, але вучоныя яшчэ не надавалі значэння таму, як атамы размяшчаюцца ў малекуле, і лічылі, што пазнаць гэта немагчыма. А. М. Бутлераў выказаў меркаванне аб тым, што атамы ў малекуле злучаны ў пэўнай паслядоўнасці, якую можна ўстанавіць хімічнымі метадамі і адлюстраваць у структурнай формуле.
Сфармулюем важнейшыя палажэнні тэорыі будовы арганічных злучэнняў А. М. Бутлерава:
1. Атамы, якія ўваходзяць у састаў арганічных злучэнняў, звязаны адзін з адным у пэўнай паслядоўнасці ў адпаведнасці з іх валентнасцю.
2. Уласцівасці рэчыва залежаць не толькі ад таго, атамы якіх элементаў і ў якой колькасці ўваходзяць у састаў малекул, але і ад паслядоўнасці злучэння атамаў у малекулах.
Дадзеная тэорыя адкрыла шлях да шырокага распаўсюджвання структурных формул для адлюстравання будовы арганічных рэчываў.
Выкарыстаем палажэнні тэорыі А. М. Бутлерава для тлумачэння супярэчнасцей, апісаных у прыкладах 1 і 2.
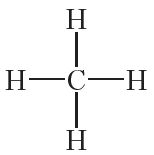
Спачатку растлумачым будову малекул найпрасцейшых вуглевадародаў. Улічваючы, што валентнасць вугляроду роўная чатыром, а валентнасць вадароду — адзінцы, структурная формула метану CH4 наступная:
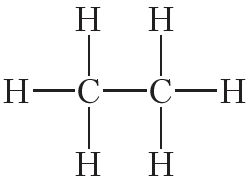
У малекуле этану C2H6 усе атамы вугляроду і вадароду ўваходзяць у састаў адной часціцы. Для гэтага два атамы вугляроду павінны ўтварыць паміж сабой хімічную сувязь. Астатнія тры адзінкі валентнасці кожны атам вугляроду выкарыстае для злучэння з трыма атамамі вадароду. Тады структурная формула этану:
Аналагічныя разважанні для прапану C3H8 прыводзяць да структурнай формулы:
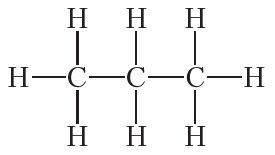
Як бачна, ва ўсіх гэтых вуглевадародах вуглярод чатырохвалентны.
Разгледзім цяпер, які ўплыў на ўласцівасці рэчываў аказвае паслядоўнасць звязвання атамаў у малекуле на прыкладзе злучэння з малекулярнай формулай C4H10. Можна скласці два ланцугі з чатырох атамаў вугляроду: лінейны і разгалінаваны:
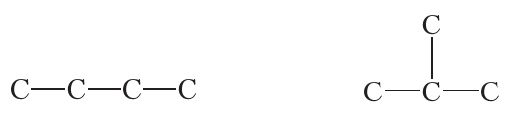
Такім чынам, малекулярную формулу C4H10 маюць два рэчывы:
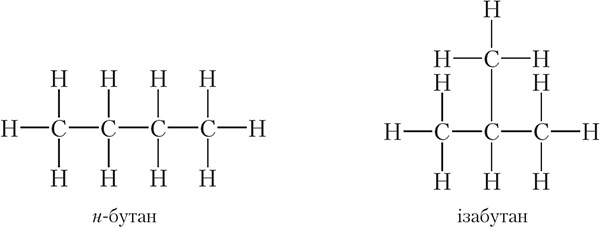
Так як н-бутан (н — скарочанае ад нармальны) і ізабутан з’яўляюцца рознымі рэчывамі, яны павінны мець розныя ўласцівасці. Сапраўды, тэмпература кіпення <em>н-бутану роўная –0,5 °С, тады як тэмпература кіпення ізабутану роўная –12 °С. Такім чынам, тэорыя Бутлерава дазволіла растлумачыць, чаму злучэнні, якія маюць зусім аднолькавы састаў, могуць валодаць рознымі ўласцівасцямі. Рэчывы, малекулы якіх маюць аднолькавы якасны і колькасны састаў, але розную будову, называюцца ізамерамі.
Далейшае развіццё навукі толькі дапаўняла і ўдасканальвала тэорыю А. М. Бутлерава, паказала яе справядлівасць не толькі для арганічных, але і для неарганічных злучэнняў. Структурныя формулы, упершыню прапанаваныя А. М. Бутлеравым, і сёння з поспехам выкарыстоўваюцца для адлюстравання будовы малекул як арганічных, так і неарганічных злучэнняў.
Значэнне гэтай тэорыі заключаецца ў сістэматызацыі велізарнага фактычнага матэрыялу, што дало магчымасць мэтанакіраванага сінтэзу новых рэчываў з зададзенымі ўласцівасцямі.
Арганічная хімія — хімія злучэнняў вугляроду.
Арганічныя злучэнні з’яўляюцца асновай жывых арганізмаў.
У аснове тэорыі будовы арганічных злучэнняў А. М. Бутлерава ляжаць уяўленні аб тым, што ўласцівасці рэчываў вызначаюцца не толькі іх саставам, але і паслядоўнасцю злучэння атамаў у малекуле.
Малекулы розных рэчываў могуць мець аднолькавы састаў, але розную паслядоўнасць злучэння атамаў у малекуле.
Пытанні і заданні
1. Атамы якога элемента ўваходзяць у састаў усіх арганічных рэчываў?
2. У чым сутнасць тэорыі «жыццёвай сілы»? Назавіце вучоных, якія ўнеслі значны ўклад у развіццё арганічнай хіміі.
3. Як можна даказаць наяўнасць атамаў вугляроду і вадароду ў саставе малекул арганічных злучэнняў?
4. Сфармулюйце важнейшыя палажэнні тэорыі будовы арганічных рэчываў. Ці справядліва гэта тэорыя для неарганічных злучэнняў?
5. Пералічыце асноўныя прынцыпы будовы малекул арганічных злучэнняў. Чаму роўная валентнасць атамаў вугляроду ў саставе арганічных рэчываў?
6. Які тып хімічнай сувязі пераважае ў малекулах арганічных злучэнняў?
7. Пры прапусканні газападобных прадуктаў поўнага акіслення арганічнага рэчыва масай 0,508 г праз лішак вапнавай вады было атрымана 3,600 г асадку. Вылічыце масавую долю (%) вугляроду ў арганічным рэчыве.