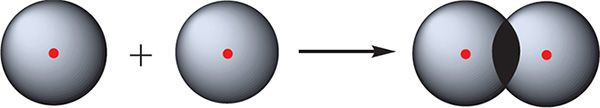§ 4. Кавалентная сувязь
Кавалентная сувязь
Асноўным тыпам хімічных сувязей у арганічных злучэннях з’яўляецца кавалентная сувязь. Разгледзім механізм яе ўтварэння і асноўныя характарыстыкі.
Найпрасцейшы прыклад злучэння з кавалентнай сувяззю — малекула вадароду Н2. Атам вадароду складаецца з дадатна зараджанага ядра і аднаго няспаранага электрона, які займае 1s-арбіталь. Пры збліжэнні двух атамаў вадароду адбываецца перакрыванне іх электронных воблакаў:
У выніку ў прасторы паміж ядрамі адбываецца павелічэнне электроннай шчыльнасці, гэта значыць у гэтай вобласці канцэнтруецца адмоўны зарад. Гэты адмоўны зарад прыцягвае дадатна зараджаныя ядры, і паміж атамамі фарміруецца хімічная сувязь. Утвараецца малекула вадароду Н ![]() Н, або Н2. Такая сувязь называецца кавалентнай. Чым больш перакрываюцца электронныя воблакі атамаў, тым больш трывалай будзе кавалентная сувязь.
Н, або Н2. Такая сувязь называецца кавалентнай. Чым больш перакрываюцца электронныя воблакі атамаў, тым больш трывалай будзе кавалентная сувязь.
Схему ўтварэння кавалентнай сувязі паміж атамамі вадароду можна прадставіць наступным чынам:
![]()
або:
![]()
З прадстаўленай схемы відаць, што кавалентная сувязь ажыццяўляецца з дапамогай агульнай электроннай пары. У электронных формулах электронную пару звычайна абазначаюць дзвюма кропкамі, размешчанымі паміж атамамі. Калі вакол такіх атамаў апісаць акружнасці, відаць, што кожны атам вадароду ў малекуле мае завершаную электронную абалонку, як у атама гелію:
![]()
У структурных формулах кавалентная сувязь абазначаецца рысачкай:
Н ![]() Н
Н
Выкарыстоўваючы паняцце агульнай электроннай пары, можна даць кароткае азначэнне кавалентнай сувязі.
Кавалентная сувязь — хімічная сувязь, утвораная пры дапамозе агульных электронных пар.
У малекуле вадароду агульная электронная пара фарміруецца за кошт няспараных электронаў двух атамаў вадароду. Такім чынам, можна зрабіць вывад, што колькасць кавалентных сувязей, якія можа ўтварыць элемент, роўна ліку няспараных электронаў у яго атаме.
Напрыклад, у атаме вадароду адзін няспараны электрон, таму вадарод можа ўтварыць толькі адну кавалентную сувязь. Лік кавалентных сувязей, які ўтварае дадзены атам у хімічным злучэнні, называецца яго валентнасцю. Напрыклад, паколькі валентнасць вадароду роўная адзінцы, то ў структурных формулах ад сімвала H трэба маляваць адну рысачку: Н ![]() Н, Н
Н, Н ![]() Cl.
Cl.
Разгледзім асноўныя характарыстыкі кавалентнай сувязі.