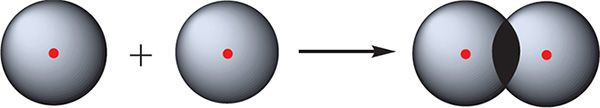§ 4. Кавалентная сувязь
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | § 4. Кавалентная сувязь |
| Напечатано:: | Гость |
| Дата: | Saturday, 25 October 2025, 05:54 |
Кавалентная сувязь
Асноўным тыпам хімічных сувязей у арганічных злучэннях з’яўляецца кавалентная сувязь. Разгледзім механізм яе ўтварэння і асноўныя характарыстыкі.
Найпрасцейшы прыклад злучэння з кавалентнай сувяззю — малекула вадароду Н2. Атам вадароду складаецца з дадатна зараджанага ядра і аднаго няспаранага электрона, які займае 1s-арбіталь. Пры збліжэнні двух атамаў вадароду адбываецца перакрыванне іх электронных воблакаў:
У выніку ў прасторы паміж ядрамі адбываецца павелічэнне электроннай шчыльнасці, гэта значыць у гэтай вобласці канцэнтруецца адмоўны зарад. Гэты адмоўны зарад прыцягвае дадатна зараджаныя ядры, і паміж атамамі фарміруецца хімічная сувязь. Утвараецца малекула вадароду Н ![]() Н, або Н2. Такая сувязь называецца кавалентнай. Чым больш перакрываюцца электронныя воблакі атамаў, тым больш трывалай будзе кавалентная сувязь.
Н, або Н2. Такая сувязь называецца кавалентнай. Чым больш перакрываюцца электронныя воблакі атамаў, тым больш трывалай будзе кавалентная сувязь.
Схему ўтварэння кавалентнай сувязі паміж атамамі вадароду можна прадставіць наступным чынам:
![]()
або:
![]()
З прадстаўленай схемы відаць, што кавалентная сувязь ажыццяўляецца з дапамогай агульнай электроннай пары. У электронных формулах электронную пару звычайна абазначаюць дзвюма кропкамі, размешчанымі паміж атамамі. Калі вакол такіх атамаў апісаць акружнасці, відаць, што кожны атам вадароду ў малекуле мае завершаную электронную абалонку, як у атама гелію:
![]()
У структурных формулах кавалентная сувязь абазначаецца рысачкай:
Н ![]() Н
Н
Выкарыстоўваючы паняцце агульнай электроннай пары, можна даць кароткае азначэнне кавалентнай сувязі.
Кавалентная сувязь — хімічная сувязь, утвораная пры дапамозе агульных электронных пар.
У малекуле вадароду агульная электронная пара фарміруецца за кошт няспараных электронаў двух атамаў вадароду. Такім чынам, можна зрабіць вывад, што колькасць кавалентных сувязей, якія можа ўтварыць элемент, роўна ліку няспараных электронаў у яго атаме.
Напрыклад, у атаме вадароду адзін няспараны электрон, таму вадарод можа ўтварыць толькі адну кавалентную сувязь. Лік кавалентных сувязей, які ўтварае дадзены атам у хімічным злучэнні, называецца яго валентнасцю. Напрыклад, паколькі валентнасць вадароду роўная адзінцы, то ў структурных формулах ад сімвала H трэба маляваць адну рысачку: Н ![]() Н, Н
Н, Н ![]() Cl.
Cl.
Разгледзім асноўныя характарыстыкі кавалентнай сувязі.
Кратнасць кавалентнай сувязі
На знешнім слоі атама фтору маецца адзін няспараны электрон, таму валентнасць фтору ў злучэннях роўная адзінцы.
![]()
Ад сімвала F у структурных формулах трэба маляваць адну рысачку: F ![]() F, H
F, H ![]() F.
F.
На малюнку 4.2 паказана схема ўтварэння кавалентнай сувязі ў малекуле фтору:

У малекуле фтору атамы звязвае адна агульная электронная пара. Такая сувязь называецца адзінарнай.
На знешнім слоі атама кіслароду маюцца два няспараныя электроны, таму валентнасць кіслароду ў злучэннях роўная двум.
![]()
Ад сімвала O ў структурных формулах трэба маляваць дзве рысачкі: O ![]() O, H
O, H ![]() O
O ![]() H.
H.
На малюнку 4.3 паказана схема ўтварэння кавалентнай сувязі ў малекуле кіслароду:

У малекуле кіслароду атамы звязваюць дзве электронныя пары. Такая сувязь называецца двайной. Двайная сувязь больш трывалая, чым адзінарная.
На знешнім слоі атама азоту маецца тры няспараныя электроны, таму валентнасць азоту ў злучэннях роўная тром.
![]()
Ад сімвала N у структурных формулах трэба маляваць тры рысачкі:

На малюнку 4.4 паказана схема ўтварэння кавалентнай сувязі ў малекуле азоту:

У малекуле азоту атамы звязваюць тры электронныя пары. Такая сувязь называецца трайной. Трайная сувязь больш трывалая, чым адзінарная і двайная.
Двайныя і трайныя сувязі маюць агульную назву кратныя.
У асноўным стане на знешнім слоі атама вугляроду маецца два няспараных электроны. Аднак атам вугляроду лёгка пераходзіць ва ўзбуджаны стан, у якім маецца чатыры няспараныя электроны:

У сувязі з гэтым валентнасць вугляроду можа быць роўная чатыром. У большасці злучэнняў вуглярод чатырохвалентны. Таму ў структурных формулах ад сімвала C трэба маляваць чатыры рысачкі:

Атамы вугляроду могуць звязвацца паміж сабой як адзінарнымі, так і кратнымі сувязямі. Напрыклад, у малекуле этану, які мае састаў С2Н6, атамы вугляроду ўтвараюць толькі адзінарныя сувязі:

Двайной кавалентнай сувяззю атамы вугляроду злучаны паміж сабой у малекуле этылену (С2Н4):

Трайная сувязь паміж атамамі вугляроду маецца ў малекуле ацэтылену (С2Н2):
![]()
Энергія і даўжыня кавалентнай сувязі
Важнейшымі характарыстыкамі кавалентнай сувязі з’яўляюцца яе энергія і даўжыня.
Энергія, якую неабходна затраціць для разрыву хімічнай сувязі, называецца энергіяй сувязі. Энергія сувязі вымяраецца ў кДж/моль. Чым больш трывалая сувязь, тым больш энергіі неабходна затраціць на яе разрыў, такім чынам, тым большая энергія сувязі.
Энергія кратных сувязей большая, чым адзінарных (табл. 4.1). Гэта цалкам зразумела, так як для разбурэння двух ці трох сувязей патрабуецца расходаваць больш энергіі, чым для разрыву адной сувязі.
| Назва рэчыва | Структурная формула | Энергія сувязі вуглярод-вуглярод, кДж /моль | Даўжыня сувязі вуглярод-вуглярод, нм |
| Этан |  |
350 | 0,154 |
| Этылен |  |
612 | 0,134 |
| Ацэтылен | 833 | 0,120 |
Атамы, злучаныя хімічнай сувяззю, знаходзяцца на пэўнай адлегласці адзін ад аднаго. Адлегласць паміж ядрамі атамаў, якія ўтвараюць сувязь, называецца даўжынёй сувязі.
З даных табліцы 4.1 відаць, што ў радзе этан — этылен — ацэтылен з ростам кратнасці даўжыня сувязі вуглярод-вуглярод памяншаецца. Гэта значыць пры ўтварэнні кратных сувязей атамы мацней прыцягваюцца адзін да аднаго.
Палярнасць кавалентнай сувязі
У малекуле вадароду H2 кавалентная сувязь утвараецца паміж атамамі аднаго элемента, таму агульная электронная пара размяшчаецца сіметрычна (пасярэдзіне) паміж ядрамі атамаў. Такая сувязь называецца кавалентнай непалярнай.
Прыклад 1. Кавалентнай непалярнай сувяззю злучаюцца паміж сабой атамы неметалаў у простых рэчывах H ![]() H, F
H, F ![]() F, Cl
F, Cl ![]() Cl, O
Cl, O ![]() O, N
O, N ![]() N.
N.
Акрамя таго, кавалентная непалярная сувязь утвараецца паміж атамамі вугляроду ў этане H3C ![]() CH3, этылене H2C
CH3, этылене H2C ![]() CH2 і ацэтылене HC
CH2 і ацэтылене HC ![]() CH.
CH.
Пры ўтварэнні кавалентнай сувязі паміж атамамі розных хімічных элементаў агульная электронная пара зрушваецца да больш электраадмоўнага атама. Такая сувязь называецца кавалентнай палярнай.
Нагадаем, што электраадмоўнасць — гэта здольнасць атама ў хімічным злучэнні прыцягваць да сябе электроны іншых атамаў. Самы электраадмоўны элемент — фтор (ЭА — 4,1).
Прыклад 2. Кавалентная палярная сувязь у малекуле фторавадароду HF.
Малекула H ![]() F утворана атамамі вадароду і фтору. Электраадмоўнасць фтору вышэйшая, чым вадароду, таму агульная электронная пара будзе зрушана да больш электраадмоўнага атама фтору (мал. 4.5).
F утворана атамамі вадароду і фтору. Электраадмоўнасць фтору вышэйшая, чым вадароду, таму агульная электронная пара будзе зрушана да больш электраадмоўнага атама фтору (мал. 4.5).

У выніку на атаме фтору ўзнікае частковы адмоўны зарад, на атаме вадароду — частковы дадатны. Частковыя, а не поўныя зарады ўзнікаюць з прычыны таго, што агульная электронная пара зрушваецца да атама фтору, але поўнага пераходу электрона ад аднаго атама да другога не адбываецца. Частковы зарад абазначаецца грэчаскай літарай δ (дэльта):
![]()
Сувязь паміж атамамі вадароду і фтору з’яўляецца кавалентнай палярнай.
Кавалентная палярная сувязь узнікае паміж атамамі неметалаў з рознай электраадмоўнасцю, напрыклад, у малекулах хлоравадароду, вады, аміяку:

Чым мацней адрозніваюцца паміж сабой электраадмоўнасці атамаў, якія ўтвараюць кавалентную сувязь, тым большымі будуць частковыя зарады на атамах і тым больш палярнай будзе сувязь.
Прыклад 3. Кавалентныя палярныя сувязі ў малекулах фторавадароду HF і хлоравадароду HCl.
| Назва рэчыва | Электраадмоўнасці элементаў | Частковыя зарады на атамах |
| Фторавадарод | ||
| Хлоравадарод |
З табліцы 4.2 відаць, што частковыя зарады на атамах у малекуле HF значна большыя, чым у малекуле HCl. Такім чынам, сувязь у малекуле HF больш палярная, чым у HCl.
Кавалентная сувязь ажыццяўляецца з дапамогай агульных электронных пар. У электронных формулах агульную электронную пару абазначаюць дзвюма кропкамі, размешчанымі паміж атамамі. У структурных формулах кавалентную сувязь абазначаюць рысачкай.
Кавалентная сувязь утвараецца паміж атамамі неметалаў. Паміж атамамі аднаго і таго ж неметала ўзнікае кавалентная непалярная сувязь. Паміж атамамі розных неметалаў — кавалентная палярная.
Кавалентная сувязь бывае адзінарнай, двайной і трайной. Двайная і трайная сувязі называюцца кратнымі.
Чым больш трывалая сувязь, тым большая энергія сувязі. Энергія кратных сувязей вышэйшая, чым энергія адзінарных сувязей. Кратныя сувязі карацейшыя, чым адзінарныя сувязі.
Пытанні і заданні
1. Пры дапамозе электронных формул адлюструйце ўтварэнне кавалентных сувязей у малекулах HCl, H2O, NH3, CH4. Укажыце валентнасці элементаў у гэтых рэчывах.
2. Улічваючы, што валентнасць вадароду і хлору роўная адзінцы, вугляроду — чатыром, а кіслароду — двум, напішыце структурныя формулы малекул: CCl4, CO2, CH3Cl, C2H6, C2H4, C2H2, C2H5Cl.
3. У якой малекуле, H2O або NH3, кавалентныя сувязі больш палярныя? Састаўце структурныя формулы гэтых малекул і ўкажыце знакі частковых зарадаў на атамах.
4. Напішыце структурную формулу пераксіду вадароду H2O2. Укажыце палярныя і непалярныя сувязі.
5. У якой малекуле, O2 ці H2O2, энергія сувязі кісларод-кісларод большая?
6. Пры моцным награванні можа адбывацца разрыў сувязей у малекулах. Пры гэтым малекулы распадаюцца на атамы. Якое рэчыва, Cl2 ці N2, будзе больш устойлівым да награвання (тэрмічна ўстойлівым)?