§ 2. Будова электронных абалонак атамаў
Асаблівасці электроннай будовы атама вугляроду
У 10-м класе вы будзеце вывучаць арганічную хімію — хімію злучэнняў вугляроду. Унікальнасць гэтага элемента заключаецца ў тым, што лік электронаў на знешнім энергетычным уроўні вугляроду (іх чатыры), роўны ліку арбіталей (якіх таксама чатыры). Гэта значыць, у атама вугляроду знешні энергетычны ўзровень запоўнены роўна напалавіну. У такім выпадку атаму нявыгадна як аддаваць, так і прымаць электроны, а выгадна іх абагульняць, утвараючы кавалентныя сувязі. Таму атамы вугляроду ўтвараюць дастаткова трывалыя сувязі адзін з адным, злучаючыся ў доўгія ланцугі або цыклы. Пры гэтым кожны атам вугляроду ўтварае чатыры кавалентныя сувязі.
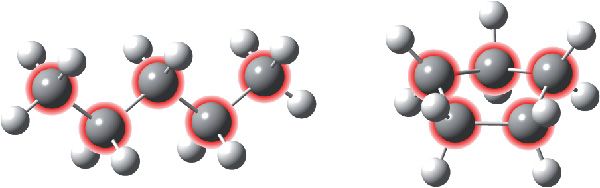
На малюнку 2.4 паказаны ланцугі і цыклы з атамаў вугляроду ў малекулах арганічных рэчываў. Свабодныя валентнасці атамаў вугляроду запоўнены атамамі вадароду (белыя шарыкі):
Будову электроннай абалонкі атама адлюстроўваюць пры дапамозе электронна-графічнай схемы або формулы электроннай канфігурацыі.
Пры складанні электронна-графічнай схемы ўлічваюць, што ў першую чаргу электронамі запаўняюцца арбіталі з найменшай энергіяй і на адной арбіталі могуць размясціцца не больш за два электроны з супрацьлеглымі спінамі.
У атаме вугляроду лік электронаў на знешнім энергетычным узроўні роўны ліку арбіталей, таму атамы вугляроду здольны ўтвараць дастаткова трывалыя кавалентныя сувязі адзін з адным, злучаючыся ў доўгія ланцугі і цыклы.