§ 1. Будова атама. Стан электрона ў атаме. Атамная арбіталь
Будова атама. Стан электрона ў атаме. Атамная арбіталь
малекулы вады
З курса хіміі 7–9-га класаў вы ўжо ведаеце, што рэчывы складаюцца з атамаў. Напрыклад, малекулы вады складаюцца з атамаў кіслароду і вадароду (мал. 1.1).
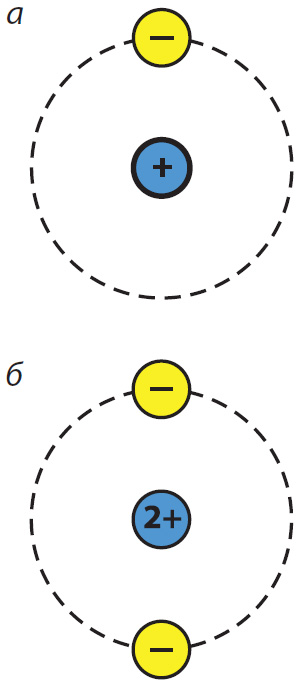
атамаў: а — вадароду;
б — гелію
У цэнтры атама знаходзіцца дадатна зараджанае ядро. Зарад ядра роўны атамнаму нумару элемента ў перыядычнай сістэме. Вакол ядра рухаюцца адмоўна зараджаныя электроны, утвараючы электронную абалонку. Дадатны зарад ядра кампенсуецца адмоўным зарадам электронаў, таму атам электранейтральны.
Напрыклад, атам вадароду складаецца з ядра, зарад якога роўны 1+, і аднаго электрона. Зарад ядра атама гелію роўны 2+, таму ў атаме гелію два электроны (мал. 1.2).
Атам — электранейтральная часціца, якая складаецца з дадатна зараджанага ядра і адмоўна зараджаных электронаў.
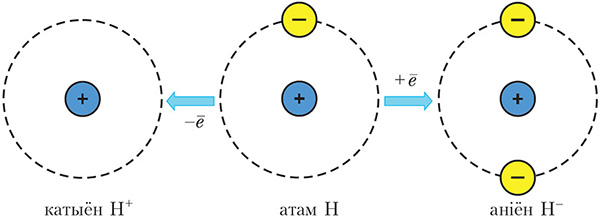
Калі атам аддае электрон, то ўтвараецца дадатна зараджаны іон — катыён. Калі атам далучае электрон, то ўтвараецца адмоўна зараджаны іон — аніён (мал. 1.3).

Электроннае воблака
атама вадароду
Гледзячы на малюнкі 1.2 і 1.3, можна памылкова меркаваць, што электроны верцяцца вакол атамнага ядра падобна таму, як планеты верцяцца вакол Сонца. У рэчаіснасці траекторыю руху электрона ў атаме вызначыць немагчыма. Кожны электрон утварае вакол ядра воблака адмоўнага зараду пэўнай формы і памеру — электроннае воблака. Напрыклад, адзіны электрон у атаме вадароду ўтварае воблака сферычнай формы (мал. 1.4).
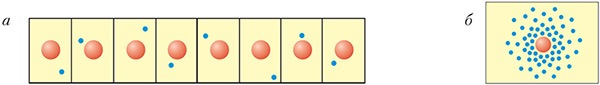
Каб лепш уявіць электроннае воблака, правядзём мысленны эксперымент. Дапусцім, у нас ёсць магчымасць сфатаграфаваць атам вадароду ў розныя моманты часу, тады на фотаздымках мы будзем бачыць электрон у розных становішчах адносна ядра (мал. 1.5). Калі зрабіць шмат такіх фотаздымкаў і накласці іх адзін на адзін, па гушчыні кропак мы ўбачым, наколькі часта электрон аказваецца ў дадзенай вобласці прасторы.
З малюнка 1.4 відаць, што электрон у атаме вадароду часцей знаходзіцца ў непасрэднай блізасці ад ядра, па меры аддалення ад ядра верагоднасць выявіць электрон рэзка зніжаецца.
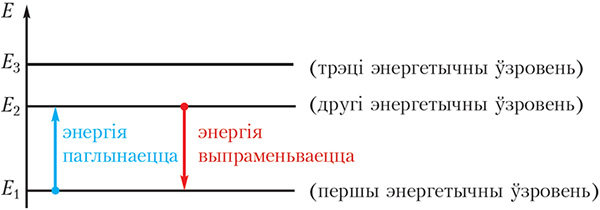
У электрона ёсць яшчэ адна асаблівасць. У атаме вадароду электрон можа мець не любыя, а толькі пэўныя значэнні энергіі. Гэтыя значэнні энергіі электрона ў атаме вадароду называюцца энергетычнымі ўзроўнямі. Энергетычныя ўзроўні абазчаюцца нумарамі.
На малюнку 1.6 паказаны энергетычныя ўзроўні атама вадароду.
Электрону найбольш выгадна займаць першы ўзровень з найменшай энергіяй, пры гэтым ён знаходзіцца бліжэй да ядра.
Электрон можа пераходзіць з аднаго энергетычнага ўзроўню на другі. Пры пераходзе з першага ўзроўню на другі ён паглынае порцыю энергіі, роўную Е2 – Е1, пры адваротным пераходзе ён выпраменьвае такую самую порцыю энергіі.
Цяпер мы можам удакладніць паняцце арбіталь, якое было ўведзена ў курсе хіміі 8-га класа. Вы ўжо ведаеце, што электрон у атаме можа знаходзіцца толькі ў пэўных станах. Кожнаму стану адпавядае пэўнае значэнне энергіі і пэўная форма электроннага воблака. Электронны стан называецца арбіталлю.
Атамная арбіталь — стан электрона ў атаме, які характарызуецца пэўным значэннем энергіі і формай электроннага воблака.
Электроннае воблака не мае дакладных межаў, таму пры адлюстраванні формы арбіталі прыводзяць не ўсё электроннае воблака, а толькі тую вобласць прасторы, унутры якой верагоднасць выявіць электрон дастаткова вялікая.
Арбіталі могуць мець розную форму. Арбіталі сферычнай формы называюцца s-арбіталямі (мал. 1.7).
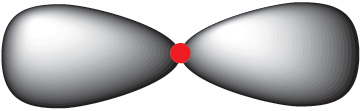
Арбіталі ў форме аб’ёмнай васьмёркі называюцца р-арбіталямі (мал. 1.8).
Атам складаецца з дадатна зараджанага ядра і адмоўна зараджаных электронаў.
Кожны электрон у атаме знаходзіцца ў стане з вызначанай энергіяй (займае пэўную атамную арбіталь).
Арбіталь характарызуецца энергіяй і формай электроннага воблака.