§ 2. Будова электронных абалонак атамаў
Будова электронных абалонак атамаў
Электроны ў атамах займаюць станы з вызначанымі энергіямі (арбіталі). Каб гэта паказаць, арбіталь адлюстроўваюць у выглядзе клетак ![]() , а электроны ў выглядзе стрэлак
, а электроны ў выглядзе стрэлак ![]() . Апошняе дазваляе адлюстраваць такую характарыстыку электрона, як спін (ад англ. spin — ‘вярчэнне’). Каб зразумець, што такое спін, уявім, што электрон у атаме не толькі рухаецца вакол ядра, але і верціцца вакол уласнай восі. У залежнасці ад таго, у які бок адбываецца вярчэнне вакол уласнай восі (па гадзіннікавай стрэлцы ці супраць), магчымы два значэнні спіна электрона. Электроны з процілеглымі спінамі абазначаюць стрэлкамі, накіраванымі ў розныя бакі.
. Апошняе дазваляе адлюстраваць такую характарыстыку электрона, як спін (ад англ. spin — ‘вярчэнне’). Каб зразумець, што такое спін, уявім, што электрон у атаме не толькі рухаецца вакол ядра, але і верціцца вакол уласнай восі. У залежнасці ад таго, у які бок адбываецца вярчэнне вакол уласнай восі (па гадзіннікавай стрэлцы ці супраць), магчымы два значэнні спіна электрона. Электроны з процілеглымі спінамі абазначаюць стрэлкамі, накіраванымі ў розныя бакі.
На адной арбіталі могуць размясціцца не больш за два электроны з супрацьлеглымі спінамі. Такія электроны называюцца спаранымі. Два спараныя электроны ўтвараюць электронную пару:
![]() — запоўненая арбіталь (электронная пара).
— запоўненая арбіталь (электронная пара).
Калі на арбіталі маецца адзін электрон, то арбіталь называецца часткова або напалавіну запоўненай, а электрон — няспараным:
![]() — часткова або напалавіну запоўненая арбіталь (няспараны электрон).
— часткова або напалавіну запоўненая арбіталь (няспараны электрон).
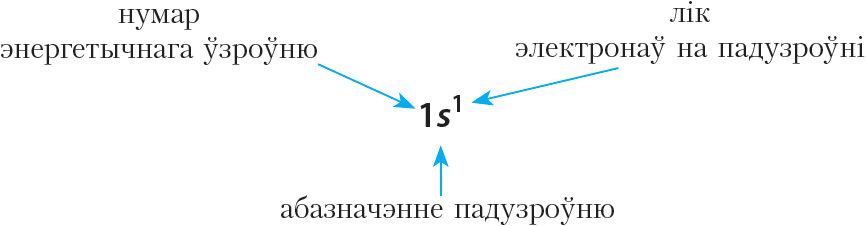
Арбіталі з аднолькавымі значэннямі энергіі ўтвараюць энергетычны падузровень. Энергетычныя падузроўні абазначаюцца літарамі s, p, d.
s-Падузровень складаецца з адной арбіталі ![]() , якая мае сферычную форму (мал. 1.7).
, якая мае сферычную форму (мал. 1.7).
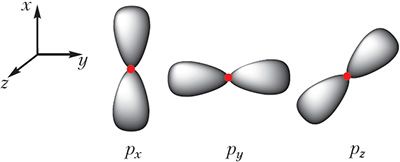
p-Падузровень складаецца з трох арбіталей ![]() , якія маюць форму аб’ёмных васьмёрак і арыентаваны ўздоўж трох каардынатных восей (мал. 2.1).
, якія маюць форму аб’ёмных васьмёрак і арыентаваны ўздоўж трох каардынатных восей (мал. 2.1).
d-Падузровень складаецца з пяці арбіталей ![]() , якія маюць яшчэ больш складаную форму.
, якія маюць яшчэ больш складаную форму.
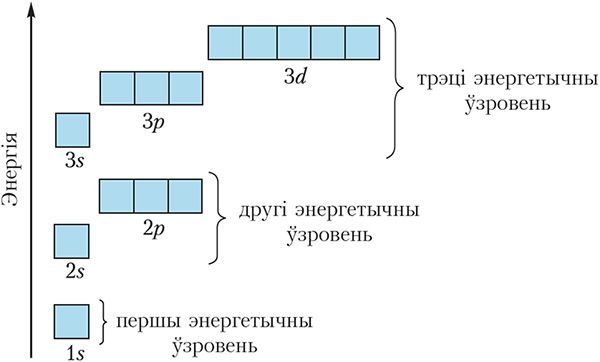
Арбіталі з блізкімі значэннямі энергіі ўтвараюць энергетычны ўзровень. На кожным энергетычным узроўні маецца строга вызначаны лік падузроўняў і, такім чынам, арбіталей, прычым іх колькасць павялічваецца з узрастаннем нумара энергетычнага ўзроўню (мал. 2.2).
З малюнка 2.2 відаць, што:
першы ўзровень складаецца з аднаго падузроўню — 1s ![]()
другі — з двух падузроўняў — 2s ![]() і 2p
і 2p ![]()
трэці — з трох падузроўняў — 3s ![]() , 3p
, 3p ![]() і 3d
і 3d ![]()
першага і другога
энергетычных узроўняў
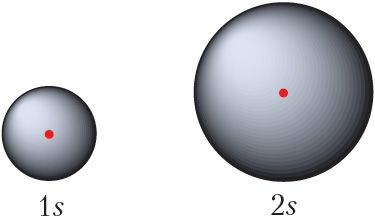
З павелічэннем нумара энергетычнага ўзроўню памеры арбіталей павялічваюцца, значэнні энергіі электронаў, якія займаюць гэтыя арбіталі, узрастаюць. Параўнайце памеры 1s- і 2s-арбіталей (мал. 2.3).
Электроны ў атаме імкнуцца займаць станы з найменшай энергіяй.
Размяшчэнне электронаў на атамных арбіталях адлюстроўвае электронна-графічная схема.
Прывядзём электронна-графічныя схемы некаторых атамаў. Пры гэтым будзем улічваць, што спачатку запаўняюцца ўзроўні і падузроўні з меншай энергіяй (мал. 2.2).
Элемент з атамным нумарам 1 — вадарод (Н). Зарад ядра атама вадароду роўны 1+, таму ў атаме вадароду маецца адзін электрон, які размяшчаецца на арбіталі з найменшай энергіяй 1s.
Электронна-графічная схема атама вадароду:
![]()
На практыцы карыстацца электронна-графічнай схемай не заўсёды зручна, прасцей для адлюстравання будовы электроннай абалонкі атама прымяняць формулу электроннай канфігурацыі (яе таксама называюць электроннай канфігурацыяй).
Напрыклад, формула электроннай канфігурацыі вадароду:
Элемент з атамным нумарам 2 — гелій (Не). Формула электроннай канфігурацыі:
Не: 1s2
Першы энергетычны ўзровень у атаме гелію завершаны. Завершаная электронная абалонка ўстойлівая, таму гелій не ўтварае хімічных злучэнняў, з’яўляецца высакародным газам, існуе ў выглядзе асобных атамаў (аднаатамных малекул). Іншыя высакародныя газы — Ne, Ar і г. д. — таксама маюць устойлівыя завершаныя электронныя абалонкі.
Атамы астатніх элементаў не маюць завершаных абалонак, таму яны ўтвараюць хімічныя злучэнні. У гэтых злучэннях атамы набываюць завершаныя абалонкі бліжэйшых высакародных газаў.
Элемент з атамным нумарам 3 — літый (Li). Яго электронная канфігурацыя:
Li: 1s22s1
З электроннай канфігурацыі атама літыю відаць, што, аддаўшы адзін знешні электрон, атам набудзе завершаную электронную абалонку, як у атама гелію. Для літыю характэрны рэакцыі, у якіх ён аддае адзін электрон, гэта значыць праяўляе аднаўленчыя ўласцівасці. У злучэннях, якія ўтвараюцца, ступень акіслення літыю роўна +1:
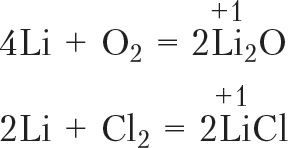
Элемент з атамным нумарам 4 — берылій (Ве). Формула электроннай канфігурацыі:
Ве: 1s22s2
На першы погляд можа здацца, што будова знешняга энергетычнага ўзроўню атама берылію такая самая, як у атама гелію, але ўласцівасці гэтых элементаў зусім розныя. Берылій — метал, у той час як гелій — высакародны газ.
Разгледзім электронна-графічную схему атама берылію. Унутранную 1s-арбіталь прыводзіць не будзем, замест яе на схеме шматкроп’е. Нагадаем, што хімічныя ўласцівасці атама вызначаюцца будовай знешняга энергетычнага ўзроўню. Электронна-графічная схема знешняга энергетычнага ўзроўню атама берылію мае выгляд:
![]()
У адрозненне ад атама гелію, знешні энергетычны ўзровень атама берылію не завершаны. Каб набыць устойлівую завершаную электронную абалонку, атам берылію павінен аддаць два электроны, таму берылій праяўляе ў злучэннях ступень акіслення +2, яго аксід мае формулу ВеО, а гідраксід — Ве(ОН)2.
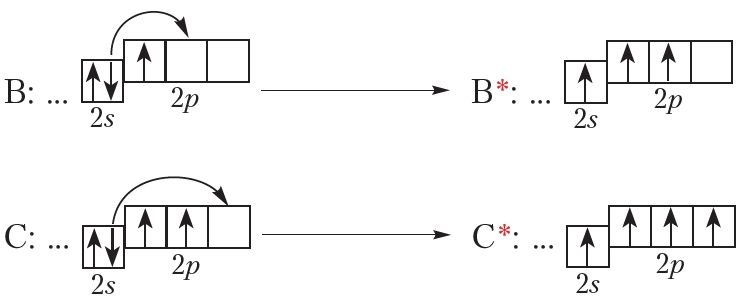
Элемент з атамным нумарам 5 — бор (В). Яго электронная канфігурацыя:
В: …2s22p1
Наступны элемент — вуглярод (С). Электронна-графічная схема і электронная канфігурацыя вугляроду:
![]()
С: …2s22p2
Як відаць з электронна-графічнай схемы, электроны ў атаме вугляроду запаўняюць розныя 2р-арбіталі. Гэта тлумачыцца тым, што, знаходзячыся на адной арбіталі, аднайменна зараджаныя электроны адчуваюць электрастатычнае адштурхоўванне, якое памяншаецца, калі электроны знаходзяцца на розных арбіталях.
Прывядзём электронна-графічныя схемы і электронныя канфігурацыі атамаў астатніх элементаў другога перыяду:
![]() або N: …2s22p3
або N: …2s22p3
![]() або О: …2s22p4
або О: …2s22p4
![]() або F: …2s22p5
або F: …2s22p5
Відаць, што атаму фтору да завяршэння электроннай абалонкі не хапае аднаго электрона, таму фтор лёгка прымае адзін электрон, праяўляючы ступень акіслення –1. Фтор — элемент з самымі ярка выражанымі неметалічнымі ўласцівасцямі.
Апошні элемент другога перыяду — неон (Nе) — мае завершаную электронную абалонку:
Ne: …2s22p6
Кожная з прыведзеных электронна-графічных схем адлюстроўвае найбольш энергетычна выгадны стан атама (яму адпавядае найменшая энергія). Такі стан называецца асноўным.
Паглынаючы энергію, атам можа пераходзіць ва ўзбуджаны стан, пры гэтым адзін або некалькі электронаў пераходзяць з адной арбіталі на другую (мал. 1.6). Энергія атама ва ўзбуджаным стане вышэй, чым у асноўным, таму ва ўзбуджаным стане атам можа знаходзіцца вельмі нядоўга і хутка вяртаецца ў асноўны стан.
Прывядзём прыклады ўзбуджаных станаў атамаў (абазначаны*):