§ 45. Строение и физические свойства аминов
Строение молекулы аммиака и иона аммония. Донорно-акцепторная связь
Формула аммиака — NH3. Рассмотрим, как образуются ковалентные связи в молекуле аммиака. На внешнем электронном слое атома азота имеется три неспаренных электрона:

В атоме водорода — один неспаренный электрон:
![]()
Тогда схему образования ковалентных связей в молекуле аммиака можно представить следующим образом:
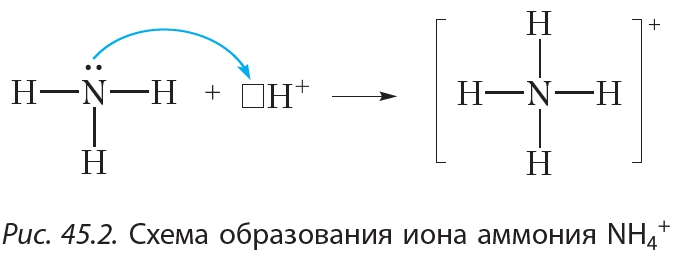
Из схемы видно, что три неспаренных электрона атома азота участвуют в образовании трёх ковалентных связей N—H. В то же время на внешнем слое атома азота остаётся электронная пара. Такая электронная пара называется неподелённой электронной парой. Структурная формула аммиака: Благодаря наличию неподелённой электронной пары атом азота молекулы аммиака может образовать ещё одну ковалентную связь. Например, молекула аммиака способна присоединять катион водорода H+, образуя ион аммония:
Благодаря наличию неподелённой электронной пары атом азота молекулы аммиака может образовать ещё одну ковалентную связь. Например, молекула аммиака способна присоединять катион водорода H+, образуя ион аммония:
или
Из рисунка 45.2 видно, что все четыре ковалентные связи N—H в ионе аммония одинаковы. Они образованы посредством общих электронных пар между атомами азота и водорода. Однако механизм образования этих связей различается. Три связи N—H образуются за счёт неспаренных электронов атомов азота и водорода (рис. 45.1). Такой способ образования ковалентной связи называется обменным. Четвёртая связь N—H в ионе аммония образуется за счёт неподелённой электронной пары атома азота и свободной орбитали катиона H+ (рис. 45.2). Такой способ образования ковалентной связи называется донорно-акцепторным. При этом атом азота, предоставляющий электронную пару, называется донором, а катион водорода, принимающий электронную пару на свою свободную орбиталь, — акцептором.
Вещества, способные присоединять катион водорода H+, являются основаниями. Следовательно, аммиак — основание. Оснóвные свойства аммиака проявляются в реакциях с кислотами. В этих реакциях образуются соли аммония:![]()
или

Видно, что в реакции с HCl молекула NH3 присоединяет катион H+ и превращается в ион аммония NH4+. В ионе аммония атом азота образует четыре ковалентные связи N—H, поэтому валентность азота равна IV. В хлориде аммония кроме ковалентных связей N—H имеется ионная связь между катионом NH+ и анионом Cl–.
Аммиак проявляет оснóвные свойства не только при взаимодействии с кислотами, но и с водой. Так, при растворении аммиака в воде протекает обратимая реакция:![]()
или
Видно, что при взаимодействии с водой молекула аммиака присоединяет катион водорода. При этом образуются ион аммония NH+ и гидроксид-ион OH–. Наличие ионов OH– обусловливает щелочную реакцию водных растворов аммиака.
Перейдём к рассмотрению строения органических азотсодержащих веществ — аминов.