§ 45. Строение и физические свойства аминов
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 45. Строение и физические свойства аминов |
| Напечатано:: | Гость |
| Дата: | Tuesday, 21 October 2025, 17:21 |
Строение и физические свойства аминов
Изучая предыдущие параграфы, вы многое узнали о строении и свойствах спиртов, альдегидов, карбоновых кислот, сложных эфиров, углеводов. Молекулы всех этих соединений содержат кислород, поэтому они относятся к кислородсодержащим органическим веществам. В то же время существует большое количество органических соединений, содержащих азот. Этими соединениями являются белки, нуклеиновые кислоты и многие другие. Прежде чем приступить к изучению азотсодержащих органических веществ, рассмотрим строение и свойства известного вам неорганического вещества аммиака.
Строение молекулы аммиака и иона аммония. Донорно-акцепторная связь
Формула аммиака — NH3. Рассмотрим, как образуются ковалентные связи в молекуле аммиака. На внешнем электронном слое атома азота имеется три неспаренных электрона:

В атоме водорода — один неспаренный электрон:
![]()
Тогда схему образования ковалентных связей в молекуле аммиака можно представить следующим образом:
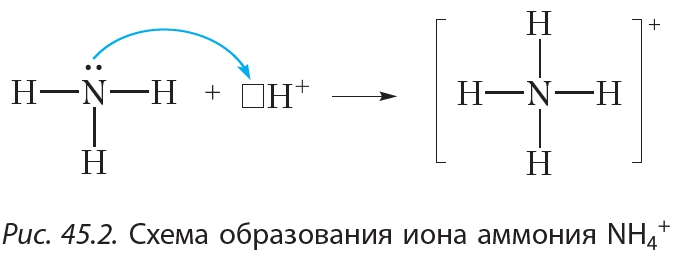
Из схемы видно, что три неспаренных электрона атома азота участвуют в образовании трёх ковалентных связей N—H. В то же время на внешнем слое атома азота остаётся электронная пара. Такая электронная пара называется неподелённой электронной парой. Структурная формула аммиака: Благодаря наличию неподелённой электронной пары атом азота молекулы аммиака может образовать ещё одну ковалентную связь. Например, молекула аммиака способна присоединять катион водорода H+, образуя ион аммония:
Благодаря наличию неподелённой электронной пары атом азота молекулы аммиака может образовать ещё одну ковалентную связь. Например, молекула аммиака способна присоединять катион водорода H+, образуя ион аммония:
или
Из рисунка 45.2 видно, что все четыре ковалентные связи N—H в ионе аммония одинаковы. Они образованы посредством общих электронных пар между атомами азота и водорода. Однако механизм образования этих связей различается. Три связи N—H образуются за счёт неспаренных электронов атомов азота и водорода (рис. 45.1). Такой способ образования ковалентной связи называется обменным. Четвёртая связь N—H в ионе аммония образуется за счёт неподелённой электронной пары атома азота и свободной орбитали катиона H+ (рис. 45.2). Такой способ образования ковалентной связи называется донорно-акцепторным. При этом атом азота, предоставляющий электронную пару, называется донором, а катион водорода, принимающий электронную пару на свою свободную орбиталь, — акцептором.
Вещества, способные присоединять катион водорода H+, являются основаниями. Следовательно, аммиак — основание. Оснóвные свойства аммиака проявляются в реакциях с кислотами. В этих реакциях образуются соли аммония:![]()
или

Видно, что в реакции с HCl молекула NH3 присоединяет катион H+ и превращается в ион аммония NH4+. В ионе аммония атом азота образует четыре ковалентные связи N—H, поэтому валентность азота равна IV. В хлориде аммония кроме ковалентных связей N—H имеется ионная связь между катионом NH+ и анионом Cl–.
Аммиак проявляет оснóвные свойства не только при взаимодействии с кислотами, но и с водой. Так, при растворении аммиака в воде протекает обратимая реакция:![]()
или
Видно, что при взаимодействии с водой молекула аммиака присоединяет катион водорода. При этом образуются ион аммония NH+ и гидроксид-ион OH–. Наличие ионов OH– обусловливает щелочную реакцию водных растворов аммиака.
Перейдём к рассмотрению строения органических азотсодержащих веществ — аминов.
Строение молекул аминов
Амины можно рассматривать как производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
Например, заместим один атом водорода молекулы аммиака на метильный радикал: Такое соединение называется метиламин. Метиламин представляет собой бесцветный газ (tкип = –6 °С) с резким запахом, напоминающим запах аммиака.
Такое соединение называется метиламин. Метиламин представляет собой бесцветный газ (tкип = –6 °С) с резким запахом, напоминающим запах аммиака.
Метиламин является простейшим представителем аминов. Его формулу можно записать следующим образом: CH3—NH2. Видно, что в молекуле метиламина имеется группа —NH2, которая называется аминогруппой.
Если заместить два атома водорода молекулы аммиака на метильные радикалы, то получится диметиламин:
Наконец, при замещении всех трёх атомов водорода молекулы аммиака на метильные радикалы получим триметиламин:
В зависимости от числа замещённых атомов водорода амины делят на первичные (замещён один атом водорода), вторичные (замещены два атома водорода) и третичные (замещены три атома водорода): Метиламин CH3—NH2 является первичным амином. Учитывая, что общая формула алкильных радикалов CnH2n+1 —, легко получить общую формулу гомологов метиламина:
Метиламин CH3—NH2 является первичным амином. Учитывая, что общая формула алкильных радикалов CnH2n+1 —, легко получить общую формулу гомологов метиламина:
СnH2n+1—NH2
В молекулах аминов, как и в молекуле аммиака, у атома азота имеется неподелённая электронная пара. Благодаря этому амины, как и аммиак, могут присоединять катион водорода H+. То есть амины являются органическими основаниями.
Названия аминов состоят из названий углеводородных радикалов, связанных с атомом азота, и окончания -амин. Приведём названия некоторых аминов:

Кроме алкильных радикалов, молекулы аминов могут содержать и другие заместители. Примером такого амина является анилин:

В молекуле анилина группа —NH2 связана с радикалом —C6H5, который называется фенил. Поэтому анилин называют также фениламином.
Анилин представляет собой бесцветную маслянистую жидкость, плохо растворимую в воде, с температурой кипения 184 °С. Анилин ядовит.
Изомерия аминов
Метиламин CH3—NH2 не имеет изомеров.
Следующие представители алкиламинов содержат два атома углерода в молекуле. В этом случае возможно существование двух изомеров:

Физические свойства аминов
В таблице 45.1 приведены структурные формулы, названия и температуры кипения некоторых насыщенных аминов.
Таблица 45.1. Структурные формулы, названия и температуры кипения насыщенных аминов
|
Формула |
Название |
tкип, °C |
|
CH3—NH2 |
метиламин |
–6 |
|
CH3—CH2—NH2 |
этиламин |
17 |
|
CH3—CH2—CH2—NH2 |
пропиламин |
49 |
|
CH3—CH2—CH2—CH2—NH2 |
бутиламин |
78 |
Из данных таблицы видно, что только метиламин имеет температуру кипения ниже 0 °С, следовательно, при нормальных условиях только метиламин является газом.
Более высокие, по сравнению с углеводородами, температуры кипения аминов обусловлены образованием водородных связей между их молекулами:
Полярность связи N—H ниже, чем связи O—H. Поэтому температуры кипения аминов ниже, чем у спиртов с тем же числом атомов углерода.
Подобно аммиаку, низшие амины хорошо растворимы в воде. С ростом углеводородных радикалов растворимость аминов в воде уменьшается. Например, анилин малорастворим в воде. В 100 г воды при комнатной температуре можно растворить примерно 3,5 г анилина.
|
Амины можно рассматривать как производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы. В зависимости от числа замещённых атомов водорода амины делят на первичные (замещён один атом водорода), вторичные (замещены два атома водорода) и третичные (замещены три атома водорода). В молекулах аминов, как и в молекуле аммиака, у атома азота имеется неподелённая электронная пара. Поэтому амины могут присоединять катион водорода H+ и являются органическими основаниями. Благодаря наличию полярных связей N—H между молекулами аминов могут образовываться водородные связи. Поэтому температуры кипения аминов выше температур кипения алканов с таким же числом атомов углерода в молекулах. Низшие амины хорошо растворимы в воде. С ростом углеводородных радикалов растворимость аминов в воде уменьшается. |
Вопросы и задания
1. Приведите примеры реакций, в которых аммиак проявляет свойства основания. Какая частица присоединяется к молекуле аммиака в этих реакциях?
2. Почему водный раствор аммиака окрашивает фенолфталеин в малиновый цвет?
3. Найдите первичные, вторичные и третичные амины среди веществ, формулы которых:

4. Напишите общую формулу гомологов метиламина.
5. Напишите структурные формулы всех изомеров пропиламина.
6. Изобразите образование водородных связей между молекулами этиламина. Могут ли образовываться водородные связи между молекулами триметиламина?
7. Массовая доля углерода в молекуле гомолога метиламина равна 61,0 %. Приведите возможную формулу этого вещества.