§ 36. Вычисления по уравнениям реакций, протекающих в растворах
Вычисления по уравнениям реакций, протекающих в растворах
Решение расчётных задач, в которых фигурируют не индивидуальные вещества, а их растворы, принципиально не отличается от решения обычных задач, требующих расчёта по уравнению химической реакции. В этом случае необходимо предварительно вычислить содержание реагирующих веществ в растворе (это может быть масса либо количество), затем следует выполнить расчёт по уравнению протекающей химической реакции. Рассмотрим примеры таких задач и их решение.
Пример 1. Имеется 50 г водного раствора муравьиной кислоты с массовой долей НСООН, равной 10 %. Рассчитайте массу 5%-го раствора NaOH, который потребуется для нейтрализации кислоты.
Решение
Уравнение протекающей реакции:
![]()
Рассчитаем массу кислоты:
m(к-ты) = ω · m(р-ра) = 0,1 · 50 = 5 г.
Рассчитаем количество кислоты:
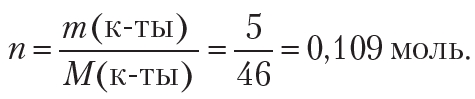
Из уравнения реакции следует, что для нейтрализации кислоты потребуется 0,109 моль щёлочи.
Рассчитаем массу щёлочи:
m(NaOH) = n · M = 0,109 моль · 40 г/моль = 4,36 г.
Рассчитаем массу 5%-го раствора NaOH:
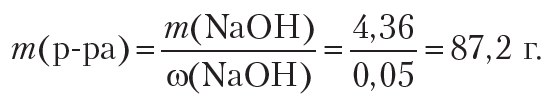
Ответ: потребуется 87,2 г 5%-го раствора щёлочи.
Пример 2. Какой объём 6%-го раствора уксусной кислоты плотностью 1,007 г/см3 потребуется для того, чтобы «погасить» 3 г питьевой соды? Какой объём углекислого газа (н. у.) при этом выделится?
Решение
Уравнение реакции взаимодействия питьевой соды с уксусной кислотой:
![]()
Рассчитаем количество соды:
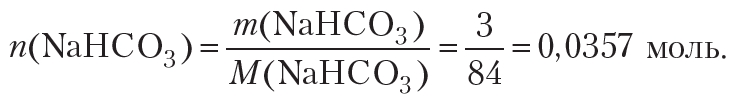
Рассчитаем объём 6%-го раствора уксусной кислоты плотностью 1,007 г/см3, который потребуется для взаимодействия с гидрокарбонатом натрия количеством 0,0357 моль:
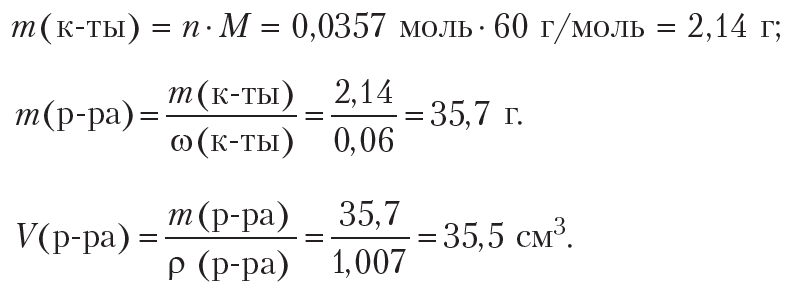
Рассчитаем объём 0,0357 моль углекислого газа (н.у.), который выделится в результате данной реакции:
V(CO2) = Vm · n = 22,4 дм3/моль · 0,0357 моль = 0,800 дм3.
Ответ: потребуется 35,5 см3 кислоты, выделится 0,800 дм3 углекислого газа.
Пример 3. Для полной нейтрализации уксусной кислоты, растворённой в 30 см3 воды, потребовалось 23,4 см3 раствора гидроксида натрия с молярной концентрацией 0,5 моль/дм3. Рассчитайте массовую долю уксусной кислоты в исходном растворе.
Решение
Уравнение протекающей реакции:
![]()
Рассчитаем количество гидроксида натрия, израсходованного на нейтрализацию уксусной кислоты:
в 1000 см3 — 0,5 моль NaOH;
в 23,4 см3 — x моль NaOH;
x = 0,0117.
Из уравнения реакции следует, что в растворе уксусной кислоты содержалось 0,0117 моль вещества. Масса уксусной кислоты:
m(к-ты) = n · M = 0,0117 моль · 60 г/моль = 0,702 г.
Рассчитаем массовую долю уксусной кислоты в исходном растворе. Напомним, что общая масса раствора является суммой масс растворителя и растворённого вещества. Плотность воды равна 1,0 г/см3.
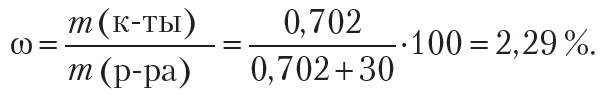
Ответ:: 2,29 %.
|
Вычисления по уравнениям реакций, протекающих в растворах, принципиально не отличаются от обычных расчётов по уравнениям химических реакций. Для решения задач такого типа следует, используя данные по составу растворов, рассчитать количества реагирующих веществ, затем выполнить расчёт по уравнению реакции. |