§ 20. Химические свойства, получение и применение бензола
*Хлорирование бензола
Хлорирование бензола
Молекула бензола может присоединить три молекулы хлора. Реакция протекает при нагревании и облучении ультрафиолетовым светом:
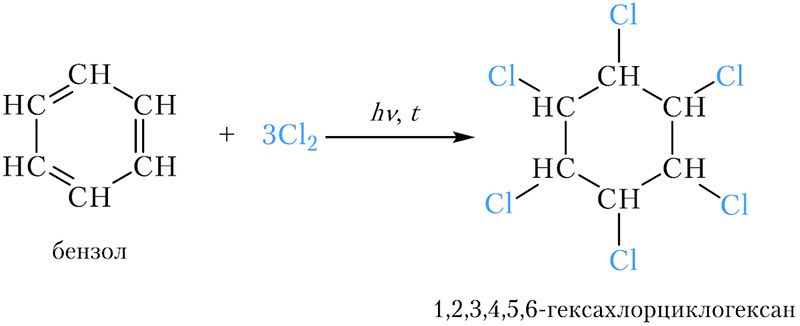
Образуется 1,2,3,4,5,6-гексахлорциклогексан, или гексахлоран. Это вещество долгое время использовалось в качестве инсектицида. Сейчас оно не применяется ввиду высокой токсичности.
Реакции гомологов бензола с участием боковой цепи
Гомологи бензола могут вступать в реакции замещения атомов водорода боковой цепи другими атомами. Используя это свойство, можно легко различить бензол и толуол. Для этого в две пробирки наливают по 2–3 см3 бензола и толуола соответственно, затем по 2–3 см3 бромной воды. Пробирки закрывают пробками и встряхивают. При этом бром из водной фазы за счёт лучшей растворимости в углеводородах переходит в органический слой, который находится сверху. При этом органический слой окрашивается в оранжевый цвет. Пробирки некоторое время интенсивно освещают. Через несколько минут можно наблюдать, что в одной из пробирок оранжевая окраска органического слоя сохранилась, тогда как во второй пробирке органический слой обесцветился. Обесцвечивание произошло в пробирке с толуолом за счёт протекания реакции замещения атома водорода метильной группы на атом брома:
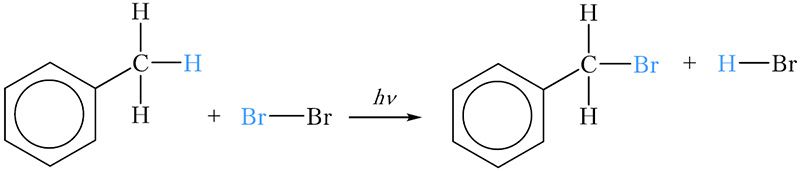
Образовавшееся бромпроизводное толуола не имеет окраски.
Эта реакция напоминает реакцию замещения атомов водорода в молекулах алканов атомами галогенов. Реакция протекает при освещении, это свидетельствует о радикальном механизме реакции замещения, инициируемой светом (§ 10).
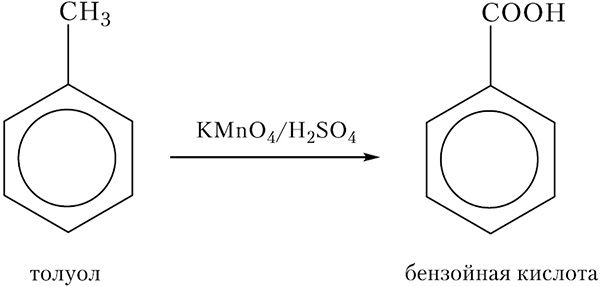
Атом углерода метильной группы в молекуле толуола легко окисляется, при этом образуется бензойная кислота. В качестве окислителя обычно используют раствор перманганата калия, подкисленный серной кислотой, либо хромовую смесь (раствор дихромата калия K2Cr2O7, подкисленный H2SO4). Схема реакции окисления толуола: