§ 18. Алкины
Химические свойства алкинов
Химические свойства алкинов сходны со свойствами алкенов, так как в молекулах веществ обоих классов имеется кратная связь. Характерными для алкинов являются реакции присоединения по тройной связи, сопровождающиеся разрывом π-связей, так как они менее прочные, чем σ-связь. Так же, как и алкены, алкины могут присоединять галогены, водород, галогеноводороды, причём одна молекула алкина может присоединить две молекулы указанных веществ.
1. Галогенирование. Присоединение галогенов
Алкины, подобно алкенам, обесцвечивают бромную воду:

Образующийся 1,2-дибромэтен содержит двойную связь, поэтому при избытке брома вступает в реакцию присоединения. В итоге образуется тетрабромпроизводное алкана: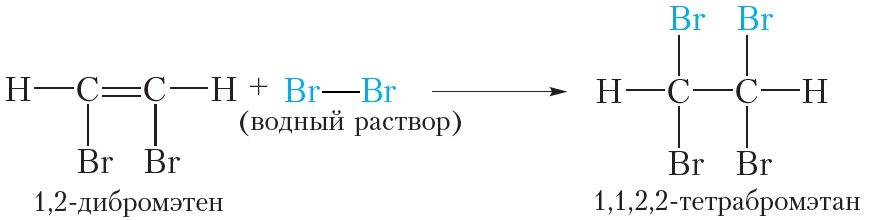
В отличие от алкенов, состав продуктов реакции алкинов с бромом зависит от количественного соотношения реагентов. При недостатке брома могут образовываться соединения, содержащие двойную связь, тогда как в избытке образуются насыщенные соединения.
Две предыдущие реакции можно объединить в одну:

Таким образом, при пропускании ацетилена через бромную воду, протекает реакция присоединения брома по тройной связи. В результате оранжевый раствор брома обесцвечивается. Подобное явление наблюдалось и для алкенов.
Следовательно, реакция с бромной водой является качественной реакцией на кратную (двойную или тройную) связь.
Так же, как этилен, ацетилен обесцвечивает водный раствор перманганата калия. Следовательно, реакция с раствором перманганата калия также является качественной реакцией на кратную (двойную или тройную) связь.
2. Гидрирование. Присоединение водорода
В результате гидрирования алкинов сначала образуются алкены, а затем алканы. Для протекания реакции необходим катализатор (Pt или Ni).
Приведём уравнения реакций, протекающих при гидрировании пропина:
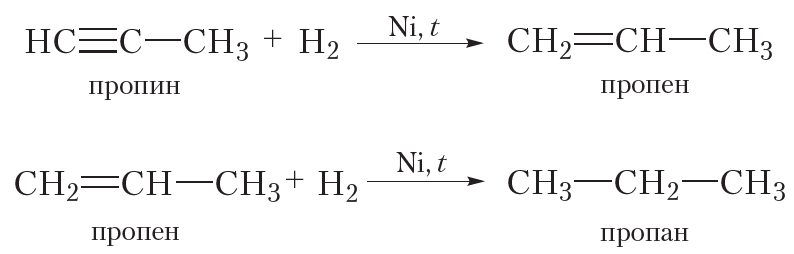
3. Гидрогалогенирование. Присоединение галогеноводородов
Алкины могут присоединять молекулы сложных веществ. В результате присоединения молекулы хлороводорода к молекуле ацетилена образуется хлорэтен:
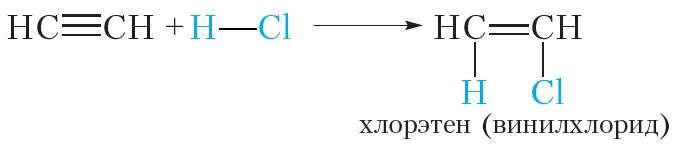 Углеводородный радикал
Углеводородный радикал ![]() имеет тривиальное называние винил. Поэтому хлорэтен
имеет тривиальное называние винил. Поэтому хлорэтен ![]() часто называют винилхлоридом. Винилхлорид — бесцветный газ со слабым сладковатым запахом, очень ядовит, tкип = –14 °С.
часто называют винилхлоридом. Винилхлорид — бесцветный газ со слабым сладковатым запахом, очень ядовит, tкип = –14 °С.
Молекула винилхлорида содержит двойную связь, поэтому он, подобно алкенам, вступает в реакцию полимеризации: 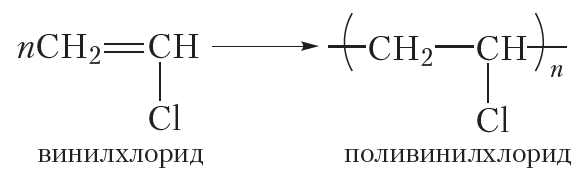
 Продукт реакции полимеризации винилхлорида — поливинилхлорид, или сокращённо ПВХ, широко используется для изготовления оконных рам, дверей, линолеума, электроизоляции проводов, искусственной кожи и других изделий.
Продукт реакции полимеризации винилхлорида — поливинилхлорид, или сокращённо ПВХ, широко используется для изготовления оконных рам, дверей, линолеума, электроизоляции проводов, искусственной кожи и других изделий.
С особенностями присоединения галогеноводородов и воды к гомологам ацетилена вы можете познакомиться, перейдя по ссылке в QR-коде.
4. Горение. Взаимодействие с кислородом
Как и все углеводороды, алкины горят. Уравнение реакции горения ацетилена: