§ 18. Алкины
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 18. Алкины |
| Напечатано:: | Гость |
| Дата: | Tuesday, 14 October 2025, 11:04 |
Алкины
Атомы углерода могут быть связаны между собой не только одинарными или двойными, но также тройными связями. Простейшим углеводородом, содержащим тройную связь, является этин или ацетилен ![]() . Рассмотрим его строение.
. Рассмотрим его строение.
Каждый атом углерода в ацетилене образует четыре химические связи. Образование этих связей происходит за счёт четырёх атомных орбиталей:

Вспомним строение этилена: 
Атомы углерода в этой молекуле находятся в состоянии sp2-гибридизации. За счет sp2-гибридных орбиталей каждый атом углерода образует три σ-связи: две связи с атомами водорода и одну — с соседним углеродом:
Вторая связь между атомами углерода образуется за счёт бокового перекрывания негибридных p-орбиталей атомов углерода — это π-связь:
В молекуле ацетилена H ![]() C
C ![]() C
C ![]() H имеется тройная связь. Она со стоит из одной σ- и двух π-связей. Так как π-связи образуются за счёт перекрывания негибридных p-орбиталей, то в гибридизации будут принимать участие одна s- и одна p-орбитали атомов углерода. Такой тип гибридизации называется sp-гибридизация:
H имеется тройная связь. Она со стоит из одной σ- и двух π-связей. Так как π-связи образуются за счёт перекрывания негибридных p-орбиталей, то в гибридизации будут принимать участие одна s- и одна p-орбитали атомов углерода. Такой тип гибридизации называется sp-гибридизация:
sp-Гибридные орбитали располагаются на одной прямой, под углом 180°. Две не участвующие в гибридизации р-орбитали атома углерода сохраняют свою первоначальную форму и располагаются взаимно перпендикулярно:
 За счёт перекрывания гибридных орбиталей каждый атом углерода образует две σ-связи — одну связь с атомом водорода и одну — с соседним углеродом:
За счёт перекрывания гибридных орбиталей каждый атом углерода образует две σ-связи — одну связь с атомом водорода и одну — с соседним углеродом:
 Орбитали, не участвующие в гибридизации, формируют две π-связи между атомами углерода:
Орбитали, не участвующие в гибридизации, формируют две π-связи между атомами углерода:

Молекула ацетилена линейная, валентный угол равен 180о. Связь между атомами углерода тройная:

Тройная связь короче двойной и одинарной: в молекуле ацетилена длина связи между атомами углерода равна 0,120 нм. Напомним, что в молекулах этилена и этана длина связи между атомами углерода составляет 0,134 и 0,154 нм соответственно.
Ацетилен является простейшим представителем алкинов — нециклических углеводородов, молекулы которых содержат одну тройную связь.
Ближайший гомолог ацетилена — пропин CH3 ![]() C
C ![]() CH. Молекулярная формула пропина С3Н4. Так как соседние члены гомологического ряда различаются по составу на группу СН2, очевидно, что следующий гомолог должен иметь состав С4Н6. Отсюда легко можно вывести общую формулу алкинов СnH2n–2. Как вы уже знаете, общую формулу СnH2n–2 имеют также алкадиены.
CH. Молекулярная формула пропина С3Н4. Так как соседние члены гомологического ряда различаются по составу на группу СН2, очевидно, что следующий гомолог должен иметь состав С4Н6. Отсюда легко можно вывести общую формулу алкинов СnH2n–2. Как вы уже знаете, общую формулу СnH2n–2 имеют также алкадиены.
Изомерия алкинов
Алкинам так же, как и алкенам, свойственна изомерия положения кратной связи и изомерия углеродного скелета:

Обратите внимание, что у алкинов изомерия углеродного скелета возможна, начиная с вещества, содержащего пять атомов углерода в молекуле. Как уже упоминалось, алкины и алкадиены имеют одинаковую общую формулу CnH2n–2. Поэтому алкины могут быть изомерны алкадиенам. Такие изомеры называются межклассовыми. Например, формулу C4H6 имеют вещества:

Номенклатура алкинов
Названия алкинов строятся так же, как и названия алкенов, но суффикс -ен в конце названия заменяется на суффикс -ин (он обозначает одну тройную связь). Цифрой в конце названия указывается положение тройной связи.
Приведём несколько примеров формул и названий алкинов:

Обратите внимание:
а) в названии «пропин» нет необходимости указывать положение тройной связи;
б) атомы углерода главной цепи нумеруют, начиная с того конца, к которому ближе тройная связь.
Физические свойства
Физические свойства алкинов подобны свойствам соответствующих алкенов. Так, алкины с числом атомов углерода в молекуле 2—4 при комнатной температуре являются бесцветными газообразными веществами. Алкины с числом атомов углерода в молекуле от 5 до 16 — жидкости. Алкины с числом атомов углерода в молекуле больше 16 представляют собой твёрдые вещества. Температуры кипения некоторых алкинов неразветвлённого строения приведены в таблице 18.1.
Таблица 18.1. Температуры кипения алкинов
|
Название |
Структурная формула |
Температура кипения (tкип, °С) |
|
Этин |
|
–84 |
|
Пропин |
|
–23 |
|
Бутин-1 |
|
8 |
|
Пентин-1 |
|
39 |
|
Гексин-1 |
|
71 |
|
Гептин-1 |
|
100 |
|
Октин-1 |
|
126 |
Алкины нерастворимы в воде, но хорошо растворимы в органических растворителях.
Плотность жидких и твёрдых алкинов меньше, чем у воды.
Химические свойства алкинов
Химические свойства алкинов сходны со свойствами алкенов, так как в молекулах веществ обоих классов имеется кратная связь. Характерными для алкинов являются реакции присоединения по тройной связи, сопровождающиеся разрывом π-связей, так как они менее прочные, чем σ-связь. Так же, как и алкены, алкины могут присоединять галогены, водород, галогеноводороды, причём одна молекула алкина может присоединить две молекулы указанных веществ.
1. Галогенирование. Присоединение галогенов
Алкины, подобно алкенам, обесцвечивают бромную воду:

Образующийся 1,2-дибромэтен содержит двойную связь, поэтому при избытке брома вступает в реакцию присоединения. В итоге образуется тетрабромпроизводное алкана: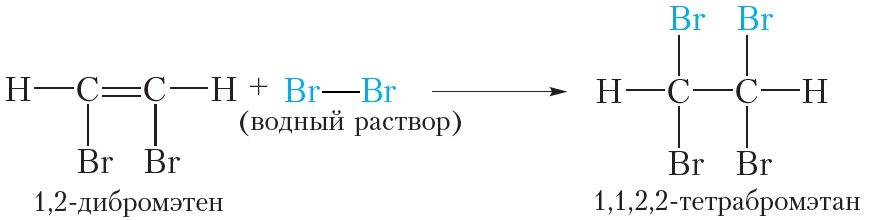
В отличие от алкенов, состав продуктов реакции алкинов с бромом зависит от количественного соотношения реагентов. При недостатке брома могут образовываться соединения, содержащие двойную связь, тогда как в избытке образуются насыщенные соединения.
Две предыдущие реакции можно объединить в одну:

Таким образом, при пропускании ацетилена через бромную воду, протекает реакция присоединения брома по тройной связи. В результате оранжевый раствор брома обесцвечивается. Подобное явление наблюдалось и для алкенов.
Следовательно, реакция с бромной водой является качественной реакцией на кратную (двойную или тройную) связь.
Так же, как этилен, ацетилен обесцвечивает водный раствор перманганата калия. Следовательно, реакция с раствором перманганата калия также является качественной реакцией на кратную (двойную или тройную) связь.
2. Гидрирование. Присоединение водорода
В результате гидрирования алкинов сначала образуются алкены, а затем алканы. Для протекания реакции необходим катализатор (Pt или Ni).
Приведём уравнения реакций, протекающих при гидрировании пропина:
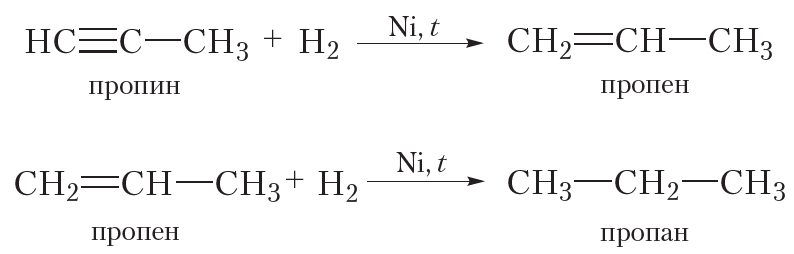
3. Гидрогалогенирование. Присоединение галогеноводородов
Алкины могут присоединять молекулы сложных веществ. В результате присоединения молекулы хлороводорода к молекуле ацетилена образуется хлорэтен:
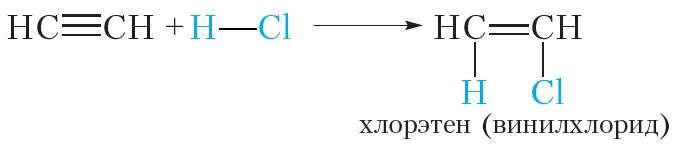 Углеводородный радикал
Углеводородный радикал ![]() имеет тривиальное называние винил. Поэтому хлорэтен
имеет тривиальное называние винил. Поэтому хлорэтен ![]() часто называют винилхлоридом. Винилхлорид — бесцветный газ со слабым сладковатым запахом, очень ядовит, tкип = –14 °С.
часто называют винилхлоридом. Винилхлорид — бесцветный газ со слабым сладковатым запахом, очень ядовит, tкип = –14 °С.
Молекула винилхлорида содержит двойную связь, поэтому он, подобно алкенам, вступает в реакцию полимеризации: 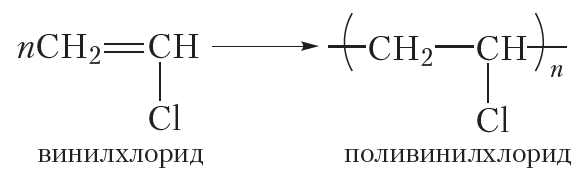
 Продукт реакции полимеризации винилхлорида — поливинилхлорид, или сокращённо ПВХ, широко используется для изготовления оконных рам, дверей, линолеума, электроизоляции проводов, искусственной кожи и других изделий.
Продукт реакции полимеризации винилхлорида — поливинилхлорид, или сокращённо ПВХ, широко используется для изготовления оконных рам, дверей, линолеума, электроизоляции проводов, искусственной кожи и других изделий.
С особенностями присоединения галогеноводородов и воды к гомологам ацетилена вы можете познакомиться, перейдя по ссылке в QR-коде.
4. Горение. Взаимодействие с кислородом
Как и все углеводороды, алкины горят. Уравнение реакции горения ацетилена:
Получение ацетилена
1. Карбидный способ
Ацетилен получают в результате действия воды на карбид кальция СаС2. Чистый карбид кальция представляет собой твёрдое белое вещество без запаха. Технический продукт имеет серый цвет и неприятный запах из-за наличия примесей.
Карбид кальция бурно реагирует с водой, при этом выделяется ацетилен:
![]()
Для получения карбида кальция используют известняк (СаСО3), при прокаливании которого образуется оксид кальция. Затем оксид кальция спекают с углём в электропечи при температуре примерно 2000 °С:

2. Пиролиз метана
Ещё одним способом получения ацетилена является частичное термическое разложение метана. Вы уже знаете, что если алканы нагреть до высокой температуры (подвергнуть пиролизу), то они разлагаются на углерод и водород (§ 10). Оказывается, одним из промежуточных продуктов пиролиза метана является ацетилен. Чтобы предотвратить разложение ацетилена, образующегося при высокой температуре (примерно 1500 °С), продукты реакции быстро охлаждают. Протекающий процесс можно отобразить уравнением:
получения алкинов

С другими методами получения алкинов вы можете познакомиться, перейдя по ссылке в QR-коде.
|
Углеводороды нециклического строения, в молекулах которых имеется одна тройная связь, называются алкинами. Общая формула алкинов CnH2n–2. Тройная связь в молекулах алкинов включает одну σ- и две π-связи. Характерными для алкинов являются реакции присоединения по тройной связи. При этом происходит расщепление π-связей. Алкины могут присоединять галогены, водород, галогеноводороды. Реакции обесцвечивания раствора перманганата калия и бромной воды являются качественными реакциями на кратную (двойную и тройную) связь. Ацетилен получают действием воды на карбид кальция и пиролизом метана. Алкины изомерны алкадиенам. |
*Присоединение галогеноводородов и воды к гомологам ацетилена
Гомологи ацетилена присоединяют галогеноводороды и воду в соответствии с правилом Марковникова, т. е. водород присоединяется к более гидрогенизированному атому углерода тройной связи.
Присоединение галогеноводородов. Гидрогалогенирование
Приведём уравнение реакции присоединения хлороводорода к пропину:

Присоединение воды. Гидратация
Присоединение воды к ацетилену происходит в присутствии солей ртути и серной кислоты. При этом образуется уксусный альдегид:

Эта реакция носит имя русского химика Михаила Григорьевича Кучерова.
Рассмотрим подробнее, как протекает данная реакция. Сначала молекула воды присоединяется по одной π-связи молекулы ацетилена. При этом образуется неустойчивый виниловый спирт:

Спирты, у которых гидроксильная группа находится при двойной связи C ![]() C неустойчивы, поэтому виниловый спирт сразу же превращается в уксусный альдегид:
C неустойчивы, поэтому виниловый спирт сразу же превращается в уксусный альдегид:

Теперь рассмотрим присоединение воды к пропину. Реакция протекает в соответствии с правилом Марковникова, поэтому в данном случае образуется кетон. Присоединение воды к пропину:

*Методы получения алкинов
Дегидрогалогенирование дигалогенпроизводных алканов
Ацетилен можно получить дегидрогалогенированием 1,2-дибромэтана спиртовым раствором щёлочи:

Как видно, от одной молекулы дигалогенпроизводного отщепляются две молекулы бромоводорода, в результате образуется ацетилен.
Можно ли получить ацетилен действием спиртового раствора щёлочи на 1,1-дибромэтан?
Вопросы и задания
1. Изобразите шаростержневую модель молекулы бутина-2. Укажите типы гибридизации атомов углерода в данной молекуле и валентные углы. Может ли бутин-2 существовать в виде пространственных цис- и транс-изомеров?
2. Существует ли углеводород разветвлённого строения, содержащий в молекуле четыре атома углерода и: а) двойную связь; б) тройную связь?
3. Напишите структурные формулы изомерных алкинов состава С5Н8. Дайте им названия. * Напишите структурные формулы межклассовых изомеров того же состава.
4. Напишите уравнение реакции присоединения одной молекулы брома к молекуле бутина-2. Назовите продукт реакции.
5. В результате неполного гидрирования алкина получается алкен, при взаимодействии которого с бромной водой образуется дибромпроизводное алкана состава C4H8Br2, молекула которого имеет симметричное строение. Приведите структурную формулу алкина и алкена, а также уравнения всех протекающих реакций.

6. При осуществлении сварочных работ для получения ацетилена из карбида кальция используются генераторы ацетилена, один из которых изображён на рисунке. Какой объём ацетилена (дм3, н. у.) можно получить из 3 кг технического карбида кальция, содержащего 22 % примесей?
7*. Газообразный углеводород, объёмом 400 мл (н. у.) смешали с кислородом, объёмом 1000 мл (н. у.) и подожгли. Вещества прореагировали полностью и образовались углекислый газ объёмом 800 мл (н. у.) и вода. Определите формулу углеводорода.
(Ответ: ацетилен.)




