§ 2. Строение электронных оболочек атомов
Особенности электронного строения атома углерода
В 10-м классе вы будете изучать органическую химию — химию соединений углерода. Уникальность этого элемента заключается в том, что число электронов на внешнем энергетическом уровне углерода (их четыре) равно числу орбиталей (которых также четыре). То есть у атома углерода внешний энергетический уровень заполнен ровно наполовину. В таком случае атому невыгодно как отдавать, так и принимать электроны, а выгодно их обобществлять, образуя ковалентные связи. Поэтому атомы углерода образуют достаточно прочные связи друг с другом, соединяясь в длинные цепи или циклы. При этом каждый атом углерода образует четыре ковалентные связи.
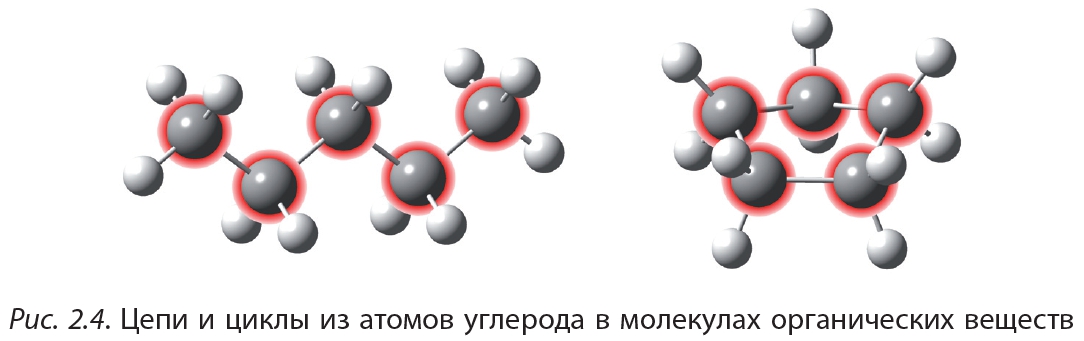
На рисунке 2.4 показаны цепи и циклы из атомов углерода в молекулах органических веществ. Свободные валентности атомов углерода заполнены атомами водорода (белые шарики):
 Неудивительно, что углерод является основой множества органических соединений. Валентность углерода, равная четырём, даёт возможность образования разветвлённых структур и кратных (двойных и тройных) связей, что обусловливает многообразие органических соединений.
Неудивительно, что углерод является основой множества органических соединений. Валентность углерода, равная четырём, даёт возможность образования разветвлённых структур и кратных (двойных и тройных) связей, что обусловливает многообразие органических соединений.
Со строением атомов химических элементов третьего периода вы можете познакомиться, перейдя по ссылке в QR-коде.
|
Строение электронной оболочки атома отображают при помощи электронно-графической схемы или формулы электронной конфигурации. При составлении электронно-графической схемы учитывают, что в первую очередь электронами заполняются орбитали с наименьшей энергией и на одной орбитали могут разместиться не более двух электронов с противоположными спинами. В атоме углерода число электронов на внешнем энергетическом уровне равно числу орбиталей, поэтому атомы углерода способны образовывать достаточно прочные ковалентные связи друг с другом, соединяясь в длинные цепи и циклы. |