§ 2. Строение электронных оболочек атомов
Строение электронных оболочек атомов
Электроны в атомах занимают состояния с определёнными энергиями (орбитали). Чтобы это показать, орбитали изображают в виде клеток ![]() , а электроны — в виде стрелок
, а электроны — в виде стрелок ![]() . Последнее позволяет отобразить такую характеристику электрона, как спин (от англ. spin — вращение). Чтобы понять, что такое спин, представим, что электрон в атоме не только движется вокруг ядра, но и вращается вокруг собственной оси. В зависимости от того, в какую сторону происходит вращение вокруг собственной оси (по часовой стрелке либо против), возможны два значения спина электрона. Электроны с противоположными спинами обозначают стрелками, направленными в разные стороны.
. Последнее позволяет отобразить такую характеристику электрона, как спин (от англ. spin — вращение). Чтобы понять, что такое спин, представим, что электрон в атоме не только движется вокруг ядра, но и вращается вокруг собственной оси. В зависимости от того, в какую сторону происходит вращение вокруг собственной оси (по часовой стрелке либо против), возможны два значения спина электрона. Электроны с противоположными спинами обозначают стрелками, направленными в разные стороны.
На одной орбитали могут разместиться не более двух электронов с противоположными спинами. Такие электроны называются спаренными. Два спаренных электрона образуют электронную пару:
![]() — заполненная орбиталь (электронная пара).
— заполненная орбиталь (электронная пара).
Если на орбитали имеется один электрон, то орбиталь называется частично или наполовину заполненной, а электрон — неспаренным:
![]() — частично или наполовину заполненная орбиталь (неспаренный электрон).
— частично или наполовину заполненная орбиталь (неспаренный электрон).
Орбитали с одинаковыми значениями энергии образуют энергетический подуровень. Энергетические подуровни обозначаются буквами s, p, d.
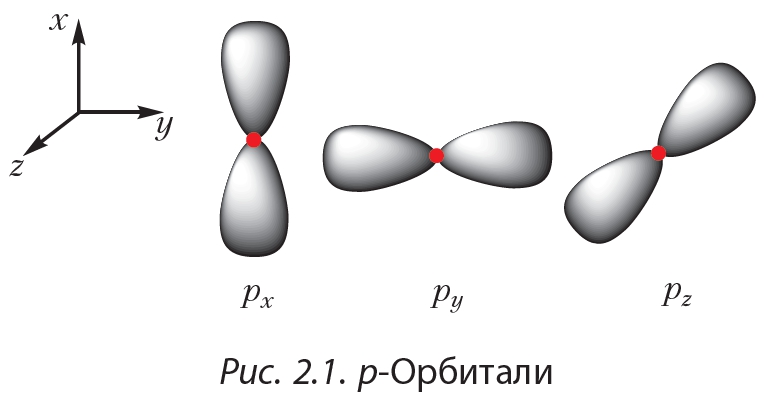
s-Подуровень состоит из одной орбиталиp-Подуровень состоит из трёх орбиталей ![]() , имеющих форму объёмных восьмёрок и ориентированных вдоль трёх координатных осей (рис. 2.1).
, имеющих форму объёмных восьмёрок и ориентированных вдоль трёх координатных осей (рис. 2.1).
d-Подуровень состоит из пяти орбиталей ![]() , имеющих ещё более сложную форму.
, имеющих ещё более сложную форму.
Орбитали с близкими значениями энергии образуют энергетический уровень. На каждом энергетическом уровне имеется строго определённое число подуровней и, следовательно, орбиталей, причём их число увеличивается с возрастанием номера энергетического уровня (рис. 2.2).
третий — из трёх подуровней — 3s![]() 3p
3p![]() и 3d
и 3d![]()
 С увеличением номера энергетического уровня размеры орбиталей увеличиваются, значения энергии электронов, занимающих эти орбитали, возрастают. Сравните размеры 1s и 2s-орбиталей (рис. 2.3).
С увеличением номера энергетического уровня размеры орбиталей увеличиваются, значения энергии электронов, занимающих эти орбитали, возрастают. Сравните размеры 1s и 2s-орбиталей (рис. 2.3).
Электроны в атоме стремятся занимать состояния с наименьшей энергией.
Расположение электронов на атомных орбиталях отражает электронно-графическая схема.
Приведём электронно-графические схемы некоторых атомов. При этом будем учитывать, что сначала заполняются уровни и подуровни с меньшей энергией (рис. 2.2).
Элемент с атомным номером 1 — водород (Н). Заряд ядра атома водорода равен 1+, поэтому в атоме водорода имеется один электрон, который располагается на орбитали с наименьшей энергией 1s.
Электронно-графическая схема атома водорода:
![]()
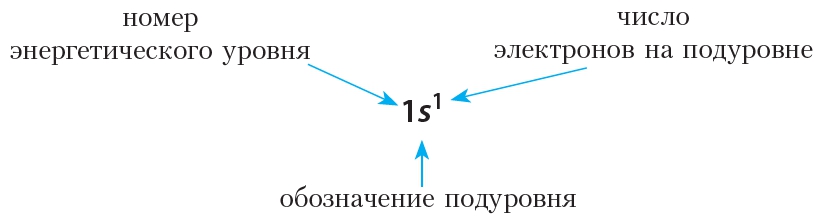
На практике пользоваться электронно-графической схемой не всегда удобно, проще для отображения строения электронной оболочки атома воспользоваться формулой электронной конфигурации (её также называют электронной конфигурацией).
Например, формула электронной конфигурации водорода:
Элемент с атомным номером 2 — гелий (Не). Формула электронной конфигурации:
Не: 1s2
Первый энергетический уровень в атоме гелия завершён. Завершённая электронная оболочка устойчива, поэтому гелий не образует химических соединений, является благородным газом, существует в виде отдельных атомов (одноатомных молекул). Другие благородные газы — Ne, Ar и т. д. — также имеют устойчивые завершённые электронные оболочки.
Атомы остальных элементов не имеют завершённых оболочек, поэтому они образуют химические соединения. В этих соединениях атомы приобретают завершённые оболочки ближайших благородных газов.
Элемент с атомным номером 3 — литий (Li). Его электронная конфигурация:
Li: 1s22s1
Из электронной конфигурации атома лития видно, что, отдав один внешний электрон, атом приобретёт завершённую электронную оболочку, как и у атома гелия. Для лития характерны реакции, в которых он отдаёт один электрон, то есть проявляет восстановительные свойства. В образующихся соединениях степень окисления лития равна +1:
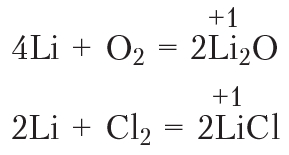
Элемент с атомным номером 4 — бериллий (Ве). Формула электронной конфигурации:
Ве: 1s22s2
На первый взгляд может показаться, что строение внешнего энергетического уровня атома бериллия такое же, как у атома гелия, но свойства этих элементов совершенно различны. Бериллий — двухвалентный металл, в то время как гелий — благородный газ.
Рассмотрим электронно-графическую схему атома бериллия. Внутреннюю 1s-орбиталь приводить не будем, вместо неё на схеме многоточие. Напомним, что химические свойства атома определяются строением внешнего энергетического уровня. Электронно-графическая схема внешнего энергетического уровня атома бериллия имеет вид:
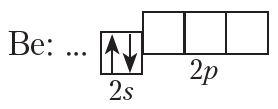
В отличие от атома гелия, внешний энергетический уровень атома бериллия не завершён. Чтобы приобрести устойчивую завершённую электронную оболочку, атом бериллия должен отдать два электрона, поэтому бериллий проявляет в соединениях степень окисления +2, его оксид имеет формулу ВеО, а гидроксид — Ве(ОН)2.
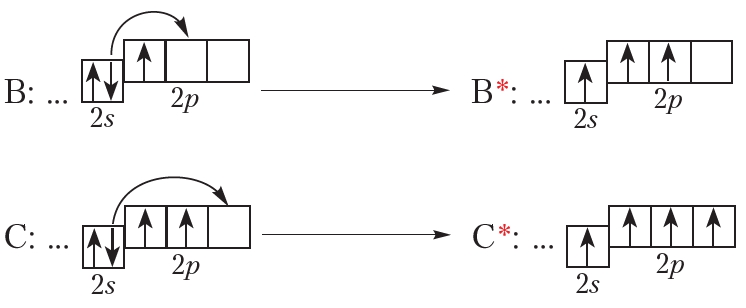
Элемент с атомным номером 5 — бор (B). Его электронная конфигурация: В: …2s22p1
Следующий элемент — углерод (С). Электронно-графическая схема и электронная конфигурация углерода:
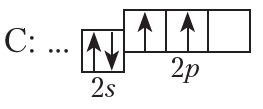
С: …2s22p2
Как видно из электронно-графической схемы, электроны в атоме углерода заполняют разные 2р-орбитали. Это объясняется тем, что, находясь на одной орбитали, одноименно заряженные электроны испытывают электростатическое отталкивание, которое уменьшается, если электроны находятся на разных орбиталях.
Приведём электронно-графические схемы и электронные конфигурации атомов остальных элементов второго периода:
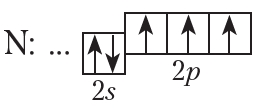 или N: …2s22p3
или N: …2s22p3
![]() или О: …2s22p4
или О: …2s22p4
![]() или F: …2s22p5
или F: …2s22p5
Последний элемент второго периода — неон (Ne) — имеет завершённую электронную оболочку:
Ne: …2s22p6
Каждая из приведённых электронно-графических схем отражает наиболее энергетически выгодное состояние атома (ему соответствует наименьшая энергия). Такое состояние называется основным.
Поглощая энергию, атом может переходить в возбуждённое состояние, при этом один или несколько электронов переходят с одной орбитали на другую (рис. 1.6). Энергия атома в возбуждённом состоянии выше, чем в основном, поэтому в возбуждённом состоянии атом может находиться очень недолго и быстро возвращается в основное состояние.
Приведём примеры возбуждённых состояний атомов (обозначены *):