§ 2. Строение электронных оболочек атомов
*Строение электронных оболочек элементов третьего периода
Первый элемент третьего периода — натрий. Его электронная конфигурация:
Na: …3s1
Как видно, конфигурация внешнего электронного слоя натрия повторяет таковую для лития — в атомах обоих элементов на внешнем слое имеется один s-электрон, который атом легко отдаёт при образовании соединений. Литий и натрий относятся к семейству щелочных металлов. Так как конфигурация внешнего электронного слоя натрия и лития одинаковая, то химические свойства этих металлов во многом подобны. Формулы электронных конфигураций атомов щелочных металлов могут быть выражены в общем виде: …ns1 (где n = 2 для лития, n = 3 для натрия и т. д.). На примере лития и натрия видно, что с увеличением заряда ядер атомов электронные конфигурации внешнего энергетического уровня периодически повторяются, поэтому периодически повторяются свойства химических элементов.
Следующий элемент № 12 — магний. Его электронная конфигурация:
Mg: …3s2
Подобно бериллию, магний — металл, проявляющий в соединениях степень окисления +2. Но поскольку валентные электроны магния находятся на третьем энергетическом уровне и располагаются дальше от ядра, чем валентные электроны бериллия, металлические свойства магния выражены сильнее, чем у бериллия. Это отражается и на характере соединений. Если оксид и гидроксид бериллия проявляют амфотерные свойства, MgO является основным оксидом, а Mg(OH)2 — основанием.
Элемент № 13 — алюминий. Al: …3s23p1. Алюминий так же, как и бор, проявляет в соединениях степень окисления +3, но, в отличие от последнего, является металлом. Оксид алюминия Al2O3 и гидроксид алюминия Al(OH)3 амфотерны.
Электронная конфигурация внешнего слоя элемента № 14 кремния повторяет таковую для углерода:
Si: …3s23p2
Кремний — неметалл. Его оксид SiO2 является кислотным оксидом, а гидроксид H2SiO3 — кислотой.
Элемент № 15 фосфор имеет такую же электронную конфигурацию внешнего электронного слоя, как и азот. Но в отличие от атома азота, атом фосфора, благодаря наличию на внешнем энергетическом уровне 3d-орбиталей, может легко переходить в возбуждённое состояние, в котором имеется пять неспаренных электронов:
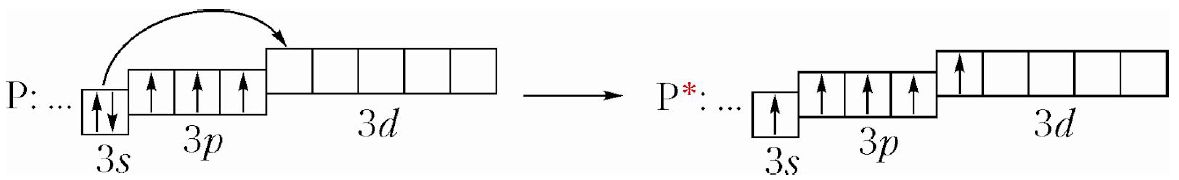
Р: …3s23p3 ![]() P*: …3s13p33d1
P*: …3s13p33d1
Валентность фосфора может быть равна III и V. Валентность III фосфор проявляет в кислотном оксиде P2O3. Валентность V — в кислотном оксиде P2O5 и фосфорной кислоте Н3РО4.
Элементы, которые могут проявлять различные валентности, называются поливалентными.
Элемент № 16 — сера. Электронная конфигурация серы:
S: …3s23p4
Как и атом фосфора, благодаря наличию d-орбиталей атом серы может легко переходить в возбуждённые состояния:
S: …3s23p4 ![]() S*: …3s23p33d1
S*: …3s23p33d1 ![]() S** …3s13p33d2
S** …3s13p33d2
В основном состоянии у атома серы имеются два неспаренных электрона, поэтому сера может проявлять валентность II (например, в сероводороде H2S). В первом возбуждённом состоянии у атома серы имеются четыре неспаренных электрона, следовательно, сера может проявлять валентность IV (SO2, Н2SO3). Второе возбуждённое состояние атома серы характеризуется наличием шести неспаренных электронов. Примеры соединений, в которых валентность серы равна VI: SO3, серная кислота H2SO4.
Следующим элементом является хлор. Атомный номер — 17, электронная конфигурация:
Cl: …3s23p5
В основном состоянии у атома хлора, как и у его электронного аналога фтора, имеется один неспаренный электрон. Примеры соединений, в которых хлор одновалентен: простое вещество Cl2, хлороводород HCl. Но, благодаря наличию d-орбиталей на третьем энергетическом уровне, атом хлора, как и атомы фосфора и серы, может легко переходить в возбуждённые состояния:
Cl: …3s23p5 ![]() Cl*: …3s23p43d1
Cl*: …3s23p43d1 ![]() Cl**: …3s23p33d2
Cl**: …3s23p33d2 ![]() Cl***: …3s13p33d3
Cl***: …3s13p33d3
Поэтому хлор может проявлять в соединениях валентности I, III, V, VII. Примеры соединений, где валентность хлора III, V и VII:

Завершается формирование 3s- и 3p-подуровней у элемента № 18 — аргона:
Ar: …3s23p6
Восьмиэлектронная оболочка аргона так устойчива, что, несмотря на наличие 3d-орбиталей, его атомы не принимают участия в образовании химических связей и аргон — инертный газ.