§ 48.1. Агульная характарыстыка металаў B-груп
Ступені акіслення атамаў d-элементаў у злучэннях
У адрозненне ад s- і р-элементаў у d-элементаў ва ўтварэнні хімічных сувязей могуць удзельнічаць не толькі s-электроны знешняга, але і d-электроны перадзнешняга слаёў. Гэта павялічвае колькасць магчымых ступеней іх акіслення. Акрамя d-элементаў IIIВ- і IIВ-груп, атамы ўсіх астатніх d-элементаў маюць некалькі ступеней акіслення (табл. 34.1).
З ростам парадкавага нумара элемента ў перыядзе максімальная (найвышэйшая) ступень акіслення ўзрастае ад IIIВ-групы да першага элемента VIIIВ-групы, а потым меншае. Найвышэйшая ступень акіслення ў большасці d-элементаў, як правіла, адпавядае нумару групы, да якой яны адносяцца. Выключэнне складаюць Fe, элементы падгрупы кобальту, нікелю і медзі (табл. 34.1).
Для атамаў элементаў IB-групы (Сu, Ag, Аu) магчымая не толькі ступень акіслення +1 (напрыклад, у злучэннях Cu2О, AgCl, Au2S), але і больш высокая (напрыклад, у злучэннях ,
).
Злучэнні элементаў, у якіх атамы могуць знаходзіцца ў ступені акіслення +8, вядомыя толькі для рутэнію і осмію (напрыклад, ). Для астатніх элементаў VIIIВ-групы характэрныя больш нізкія ступені акіслення.
Максімальная ступень акіслення для жалеза роўная +6 (напрыклад, у злучэнні K2FeO4). У ёй жалеза з’яўляецца моцным акісляльнікам.
Табліца 34.1. Формулы электроннай канфігурацыі, лік валентных электронаў і характэрныя ступені акіслення* атамаў 3d-элементаў
| Група | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | ||
| Элементы | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn |
| Ступені акіслення | +7 | |||||||||
| +6 | +6 | +6 | ||||||||
| +5 | ||||||||||
| +4 | +4 | +4 | ||||||||
| +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | |||
| +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | ||
| +1 | ||||||||||
| Электронная канфігурацыя валентнасці слоя | 3d14s2 | 3d24s2 | 3d34s2 | 3d54s1 | 3d54s2 | 3d64s2 | 3d74s2 | 3d84s2 | 3d104s1 | 3d104s2 |
*Найбольш устойлівыя ступені акіслення вылучаны колерам
Калі ў элементаў А-груп з павелічэннем парадкавага нумара па групе ўстойлівасць злучэнняў, у якіх атамы элемента праяўляюць найвышэйшую ступень акіслення, памяншаецца, то ў элементаў В-груп назіраецца зваротная заканамернасць: па групе зверху ўніз устойлівасць злучэнняў элементаў у найвышэйшай ступені акіслення атама, як правіла, павышаецца. Найвышэйшыя ступені акіслення ў злучэннях характэрныя для золата (+3), плаціны (4), осмію (+8), вальфраму (+ 6).
У нізкіх ступенях акіслення атамы d-элементаў утвараюць хімічныя сувязі, блізкія да іоннага тыпу, і ў растворах існуюць у выглядзе катыёнаў, напрыклад Mn2+, Fe2+, Ag+:
MnCl2 → Mn2+ + 2Cl–.
У найвышэйшых ступенях акіслення для d-элементаў характэрны аніённыя формы злучэнняў з кавалентным тыпам хімічнай сувязі, напрыклад у іоне .
Структурныя формулы сернай і хромавай кіслаты, у якіх атамы знаходзяцца ў аднолькавых ступенях акіслення, аднатыпныя:
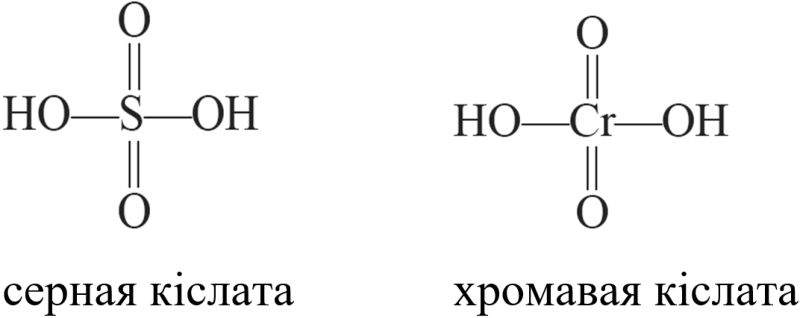
Злучэнні элементаў В-груп у найвышэйшых ступенях акіслення праяўляюць падабенства ва ўласцівасцях са злучэннямі элементаў у тых жа ступенях акіслення А-груп. У іх аналагічныя формулы аксідаў, гідраксідаў, кіслот і солей. Напрыклад, хром, элемент VIB-групы, у ступені акіслення +6 утварае кіслотны аксід CrO3 і кіслату H2CrO4, якія па саставе і акісляльнааднаўленчых уласцівасцях аналагічныя злучэнням серы, элемента VIА-групы, у той жа ступені акіслення +6: SO3 і H2SO4.
Такое падабенства характэрна для марганцу, элемента VIIB-групы, і хлору, элемента VIIА-групы. У ступені акіслення +7 марганец утварае аксід Mn2O7 малекулярная вадкасць) і адпаведную яму кіслату HMnO4. Хлор у той жа ступені акіслення (+7) утварае кіслотны аксід Cl2O7 (таксама малекулярная вадкасць) і кіслату HClO4.
Блізкасць уласцівасцей гэтых элементаў можна растлумачыць аднолькавым лікам няспараных электронаў, якія ўдзельнічаюць ва ўтварэнні хімічных сувязей з кіслародам.
| S | Cr | Cl |
| 6 | 6 | 7 |