§ 32. Элементы VIА-групы. Кісларод і сера
Кісларод як простае рэчыва
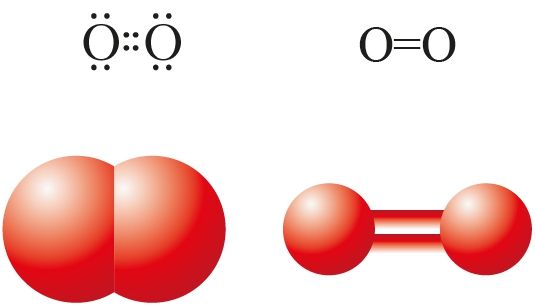
Кісларод існуе ў прыродзе ў выглядзе двух простых рэчываў (алатропных мадыфікацый) малекулярнай будовы — кіслароду О2 і азону О3.
У малекуле кіслароду існуе двайная кавалентная непалярная сувязь (мал. 29, 72).
Фізічныя ўласцівасці кіслароду. Кісларод мала раствараецца ў вадзе: пры 20 °С на 1 дм3 вады раствараецца 31 см3 кіслароду. Тым не менш гэтага хапае для дыхання рыб у вадаёмах. Вадкі кісларод — рухомая, злёгку блакітнаватая вадкасць, якая кіпіць пры тэмпературы –183 °С. Цвёрды кісларод уяўляе сабой сінія крышталі, што плавяцца пры яшчэ больш нізкай тэмпературы –219 °С.
Хімічныя ўласцівасці кіслароду. Кісларод ва ўсіх рэакцыях, акрамя ўзаемадзеяння з фторам, праяўляе ўласцівасці акісляльніку. Пры акісленні кіслародам простых і складаных рэчываў утвараюцца, як правіла, аксіды.
1. Кісларод узаемадзейнічае з металамі:
Ён акісляе практычна ўсе металы, акрамя серабра, золата і плаціны. З актыўнымі металамі кісларод можа ўтвараць не толькі аксіды, але і пераксіды (Na2O2), надпераксіды (KО2) або іншыя бінарныя злучэнні.
2. Рэагуючы з неметаламі, кісларод утварае кіслотныя або нясолеўтваральныя аксіды:
З хлорам, бромам і ёдам кісларод не рэагуе.
3. Кісларод акісляе складаныя неарганічныя і арганічныя рэчывы:
Пры гэтым адзначым, што гарэнне вуглевадародаў выкарыстоўваюць як крыніцу цеплавой энергіі:
CH4(г) + 2O2(г) = CO2(г) + 2H2(г)O(в) + 891 кДж.
У арганічным сінтэзе кісларод шырока ўжываецца ў рэакцыях каталітычнага акіслення: