§ 32. Элементы VIА-групы. Кісларод і сера
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Падручнік: | § 32. Элементы VIА-групы. Кісларод і сера |
| Надрукаваны: | Госць |
| Дата: | Аўторак 12 Жнівень 2025 |
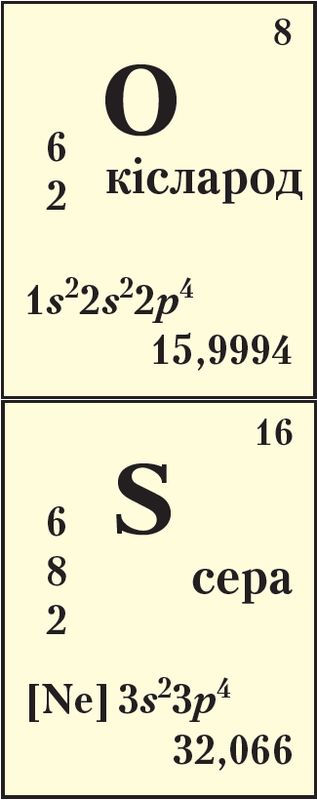
Кісларод і сера як хімічныя элементы
Элементы VIА-групы кісларод 8О, сера 16S, селен 34Se і тэлур 52Те маюць агульную назву халькагены, што ў перакладзе азначае «якія нараджаюць руду». Сапраўды, пераважная колькасць прыродных мінералаў утрымлівае кісларод або серу, напрыклад магнетыт Fe3O4, халькапірыт CuFeS2.
Як вам вядома, кісларод — самы распаўсюджаны элемент на Зямлі, ён складае 49 % ад масы зямной кары.
Сера — шаснаццаты па распаўсюджанасці элемент, сустракаецца як у выглядзе злучэнняў, так і ў самародным стане (табл. 26).
Табліца 26. Хімічныя элементы халькагены
| Элемент | Радыус атама, нм | χ | Ступені акіслення | Прыродныя злучэнні |
| Кісларод 8О | 0,073 | 3,5 | –2, –1, 0, +2 | О2, О3, H2O, мінералы, арганічныя злучэнні |
| Сера 16S | 0,104 | 2,6 | –2, –1, 0, +4, +6 | Сера самародная S, медны калчадан (халькапірыт) СuFеS2, жалезны калчадан (пірыт) FeS2, глаўберава соль Na2SO4 ∙ 10H2O, бялкі |
| Селен 34Se | 0,117 | 2,5 | –2, 0, +4, +6 | Селен самародны Se (сустракаецца рэдка), злучэнні з жалезам, свінцом, ртуццю (селеніды) у сульфідных радовішчах, арганічныя злучэнні — селенабялкі |
| Тэлур 52Te | 0,137 | 2,1 | –2, 0, +4, +6 | Тэлур самародны Те (у радовішчах серы і селену), злучэнні з меддзю, свінцом, цынкам, серабром, золатам (тэлурыды) у радовішчах адпаведных металаў |
На знешнім электронным слоі, агульная канфігурацыя якога ns2np4, атамы халькагенаў маюць па 6 электронаў, з якіх два няспараныя на р-падузроўні (Дадатак 1):
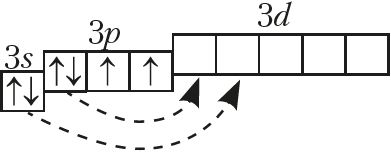
З прыведзеных электронных канфігурацый знешняга электроннага слоя атамаў кіслароду, серы вынікае, што найніжэйшая ступень акіслення гэтых халькагенаў –2. Сера праяўляе дадатныя ступені акіслення +4, +6 пры ўзбуджэнні s- і p-электронаў знешняга слоя на d-падузровень. Сера па электраадмоўнасці саступае галагенам (акрамя ёду), азоту і кіслароду. Кісларод, які з’яўляўся другім пасля фтору па электраадмоўнасці, праяўляе дадатную ступень акіслення +2 толькі ў злучэнні са фторам .
Непрыемныя пахі, што адчуваюцца пры гніенні трупаў жывёл, можна растлумачыць вылучэннем злучэнняў серы (меркаптанаў і серавадароду), якія ўтвараюцца пры раскладанні бялкоў.
Кісларод як простае рэчыва
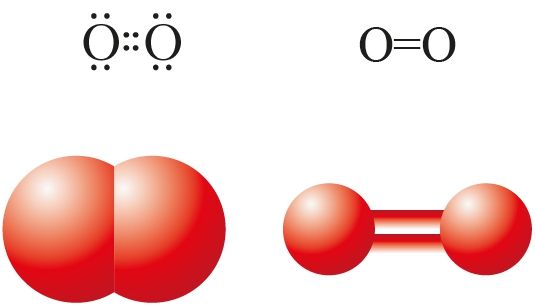
Кісларод існуе ў прыродзе ў выглядзе двух простых рэчываў (алатропных мадыфікацый) малекулярнай будовы — кіслароду О2 і азону О3.
У малекуле кіслароду існуе двайная кавалентная непалярная сувязь (мал. 29, 72).
Фізічныя ўласцівасці кіслароду. Кісларод мала раствараецца ў вадзе: пры 20 °С на 1 дм3 вады раствараецца 31 см3 кіслароду. Тым не менш гэтага хапае для дыхання рыб у вадаёмах. Вадкі кісларод — рухомая, злёгку блакітнаватая вадкасць, якая кіпіць пры тэмпературы –183 °С. Цвёрды кісларод уяўляе сабой сінія крышталі, што плавяцца пры яшчэ больш нізкай тэмпературы –219 °С.
Хімічныя ўласцівасці кіслароду. Кісларод ва ўсіх рэакцыях, акрамя ўзаемадзеяння з фторам, праяўляе ўласцівасці акісляльніку. Пры акісленні кіслародам простых і складаных рэчываў утвараюцца, як правіла, аксіды.
1. Кісларод узаемадзейнічае з металамі:
Ён акісляе практычна ўсе металы, акрамя серабра, золата і плаціны. З актыўнымі металамі кісларод можа ўтвараць не толькі аксіды, але і пераксіды (Na2O2), надпераксіды (KО2) або іншыя бінарныя злучэнні.
2. Рэагуючы з неметаламі, кісларод утварае кіслотныя або нясолеўтваральныя аксіды:
З хлорам, бромам і ёдам кісларод не рэагуе.
3. Кісларод акісляе складаныя неарганічныя і арганічныя рэчывы:
Пры гэтым адзначым, што гарэнне вуглевадародаў выкарыстоўваюць як крыніцу цеплавой энергіі:
CH4(г) + 2O2(г) = CO2(г) + 2H2(г)O(в) + 891 кДж.
У арганічным сінтэзе кісларод шырока ўжываецца ў рэакцыях каталітычнага акіслення:

Атрыманне кіслароду
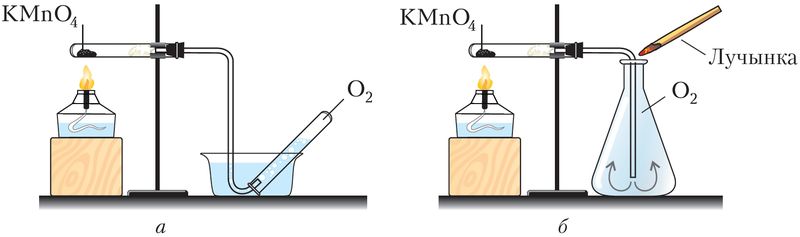
У прамысловасці кісларод атрымліваюць раздзяленнем вадкага паветра, невялікія порцыі захоўваюць у балонах блакітнага колеру, а ў лабараторыях — у газаметрах (мал. 73). Найважнейшым лабараторным спосабам яго атрымання служыць раскладанне некаторых кіслародзмяшчальных рэчываў — перманганату калію, берталетавай солі, вады, пераксіду вадароду:
У посуд кісларод збіраюць метадам выцяснення вады ці паветра (мал. 74).
Азон
Азон — газ з рэзкім пахам, мае бледна-блакітны колер, у вадкім стане — сіні. У працэсе рэакцый азон распадаецца з утварэннем атамарнага кіслароду:
О3 = О2 + О,
таму ў параўнанні з кіслародам валодае большай хімічнай актыўнасцю.
У прыродзе азон утвараецца з атмасфернага кіслароду пры навальнічных разрадах, а на вышыні 10–30 км — пад дзеяннем ультрафіялетавага выпраменьвання. Азонавы слой над паверхняй Зямлі затрымлівае караткахвалевае ультрафіялетавае выпраменьванне Сонца, шкоднае для жывых арганізмаў.
Азон утвараецца пры працы лазерных прынтараў, крыніц рэнтгенаўскага і ультрафіялетавага выпраменьвання. Памежна дапушчальная канцэнтрацыя (ПДК) азону ў паветры працоўнай зоны складае 0,1 мг/м3. Характэрны пах азону адчуваецца ўжо пры канцэнтрацыях 0,004–0,010 мг/м3, гэта значыць у шмат разоў ніжэйшых за гігіенічны нарматыў, што важна для персаналу, які працуе з азонам.
Ваду абеззаражваюць хлараваннем або азанаваннем. Азанаванне вады больш бяспечнае для чалавечага арганізма, чым хлараванне.
Сера
Састаў і будова малекулы серы. Малекулы крышталічнай серы маюць форму замкнёных цыклаў. Калі расплаўленую серу выліць у шклянку з халоднай вадой (хутка астудзіць), то ўтворыцца пластычная сера. Яе малекулы ўяўляюць сабой доўгія ланцугі (мал. 75). Пластычная сера няўстойлівая і ўжо праз некалькі гадзін пасля атрымання ператвараецца ў жоўтыя крышталі рамбічнай серы як найбольш устойлівай з алатропных мадыфікацый.

Вядома некалькі алатропных мадыфікацый серы: дзве крышталічныя — монаклінная S8 (Tпл.= 119,3 °С) і рамбічная S8 (Tпл.= 112,8 °С), а таксама пластычная S∞ (мал. 75). Найбольш устойлівая пры пакаёвай тэмпературы рамбічная сера.
Хімічныя ўласцівасці. Сера — дастаткова актыўны неметал. Пры награванні лёгка акісляецца кіслародам і галагенамі, рэагуе як акісляльнік з вадародам і металамі (акрамя золата і плаціны):
| Сера як адноўнік | Сера як акісляльнік |
Прымяненне кіслароду і серы. Найбольш значныя сферы ўжывання кіслароду і серы паказаны ў табліцы 27.
Табліца 27. Сферы ўжывання кіслароду, азону і серы
| О2 | Зварка і рэзка металаў. Акісляльнік ракетнага паліва. Дыхальныя сумесі — космас, падводныя лодкі, медыцына. Хімічная прамысловасць — атрыманне аксідаў, кіслот і інш. Арганічны сінтэз — альдэгіды, карбонавыя кіслоты. Металургія |
| О3 | Адбельвальны сродак. Дэзынфекцыйны сродак у медыцыне. Абеззаражванне пітной вады і сцёкавых водаў |
| S | Вытворчасць сернай кіслаты. Вытворчасць гумы. Вытворчасць запалак. Вытворчасць фарбавальнікаў, пігментаў |
Кісларод знайшоў ужыванне ў дыхальных апаратах (мал. 76).
Электронная канфігурацыя валентнага слоя халькагенаў ns2np4. Найніжэйшая ступень іх акіслення –2.
Кісларод як акісляльнік рэагуе з простымі і складанымі рэчывамі, утвараючы, як правіла, аксіды.
Сера з’яўляецца акісляльнікам у рэакцыях з металамі і вадародам, але адноўнікам у рэакцыях з кіслародам.
Пытанні, заданні, задачы
1. Пералічыце найбольш характэрныя ступені акіслення:
- а) кіслароду;
- б) серы;
- в) селену.
Прывядзіце прыклады адпаведных злучэнняў.
2. Назавіце алатропныя мадыфікацыі:
- а) кіслароду;
- б) серы.
3. Складзіце формулы аксідаў і сульфідаў літыю, магнію, алюмінію.
4. Разлічыце масу порцыі серы колькасцю 3,5 моль.
5. Запоўніце табліцу «Кісларод і сера ў акісляльна-аднаўленчых рэакцыях», склаўшы ўраўненні адпаведных рэакцый.
| Рэагенты | Кісларод | Сера |
| Н2 | ||
| Mg | ||
| Ca | ||
| Fe | ||
| Li | ||
| Na |
6. Складзіце 10 ураўненняў магчымых рэакцый паміж рэчывамі, формулы якіх Ba, K, Рt, ZnS, S, H2, O2. Пакажыце пры гэтым ступені акіслення элементаў.
7. Чаму роўны аб’ём паветра, неабходны для спальвання:
- а) серы масай 12 г;
- б) бутану аб’ёмам 10 м3 (н. у.)?
8. Разлічыце аб’ём кіслароду, які можа быць атрыманы пры раскладанні берталетавай солі масай 49 г.
9. Складзіце ўраўненні рэакцый паводле схемы:
- a)
;
- б)
.
10. Пры награванні перманганату калію масай 3,16 г атрыманы кісларод аб’ёмам 168 см3 (н. у.). Вызначце масавую долю солі, якая расклалася.
*Самакантроль
1. Найніжэйшая ступень акіслення атамаў халькагенаў роўная:
- а) −4;
- б) −2;
- в) +4;
- г) +6.
2. Укажыце выразы, якія характарызуюць серу як простае рэчыва:
- а) пры гарэнні серы ў кіслародзе ўзнікае блакітнае полымя;
- б) на знешнім энергетычным узроўні атама серы знаходзіцца 6 электронаў;
- в) сера выкарыстоўваецца для вулканізацыі каўчуку;
- г) сера ўваходзіць у састаў пірыту і меднага калчадану.
3. З кіслародам могуць рэагаваць:
- a) СuS;
- б) С2Н6;
- в) Cl2;
- г) H2.
4. Да халькагенаў адносяцца элементы з канфігурацыяй знешняга электроннага слоя атама:
- а) ns2np2;
- б) 2s22p4;
- в) ns2np4;
- г) 4s24p4.
5. Лік атамаў у порцыі азону колькасцю 0,1 моль роўны:
- а) 6,02 ∙ 10−22;
- б) 6,02 ∙ 1022;
- в) 1,204 ∙ 1023;
- г) 1,806 ∙ 1023.