§ 29. Вадарод
Вадарод як простае рэчыва
Вадарод як простае рэчыва складаецца з двухатамных малекул Н2, у якіх атамы звязаны кавалентнай адзінарнай σ-сувяззю, што ўтвараецца пры перакрыванні 1s-арбіталей:
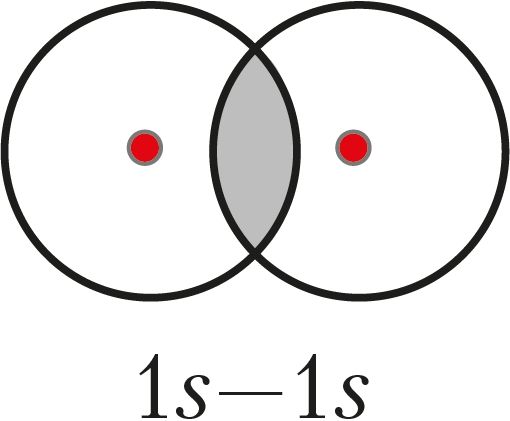
Электронная і графічная формулы малекулы маюць выгляд: Н:Н і Н—Н.
Фізічныя ўласцівасці. Вадарод пры нармальных умовах — гэта газ без колеру, паху і смаку, шчыльнасцю 0,089 г/дм3. Мае вельмі нізкія тэмпературы кіпення (–252,6 °С) і плаўлення (–259,2 °С). Растваральнасць вадароду ў вадзе як палярным растваральніку малая, таму яго можна збіраць у посуд метадам выцяснення вады. Вадарод добра раствараецца ў многіх металах (Ni, Pt, Pd і інш.).
Хімічныя ўласцівасці. Хімічная актыўнасць вадароду пры пакаёвай тэмпературы невялікая, бо высокая трываласць кавалентнай сувязі ў малекуле. У хімічных рэакцыях вадарод можа быць як адноўнікам (што больш характэрна), так і акісляльнікам.
1. Рэакцыі з простымі рэчывамі:
а) рэагуе як адноўнік з неметаламі, атамы якіх маюць у параўнанні з вадародам больш высокую электраадмоўнасць — галагенамі, азотам, серай, кіслародам:
Варта адзначыць, што вадарод не ўзаемадзейнічае з фосфарам і крэмніем;
б) рэагуе як акісляльнік са шчолачнымі і шчолачназямельнымі металамі, утвараючы гідрыды:
Гідрыды лёгка раскладаюцца вадой з вылучэннем вадароду:
2. Рэакцыі са складанымі рэчывамі:
а) узаемадзейнічае з некаторымі аксідамі металаў B-груп як адноўнік:
б) рэагуе з арганічнымі рэчывамі, якія ўтрымліваюць кратныя сувязі (рэакцыя гідрыравання) — алкенамі, алкінамі, дыенамі, арэнамі, а таксама альдэгідамі. Напрыклад:
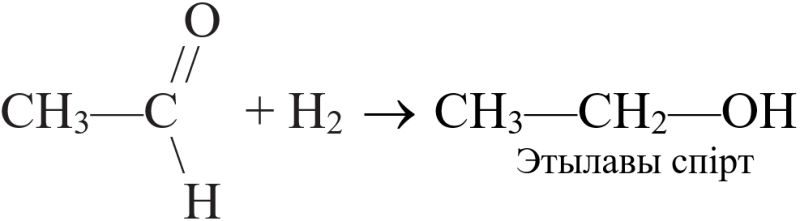
Рэагуе з трыгліцэрыдамі, якія ўтрымліваюць астаткі ненасычаных карбонавых кіслот:
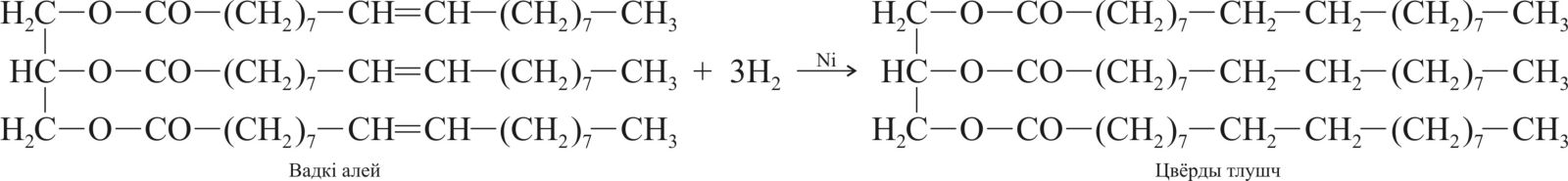
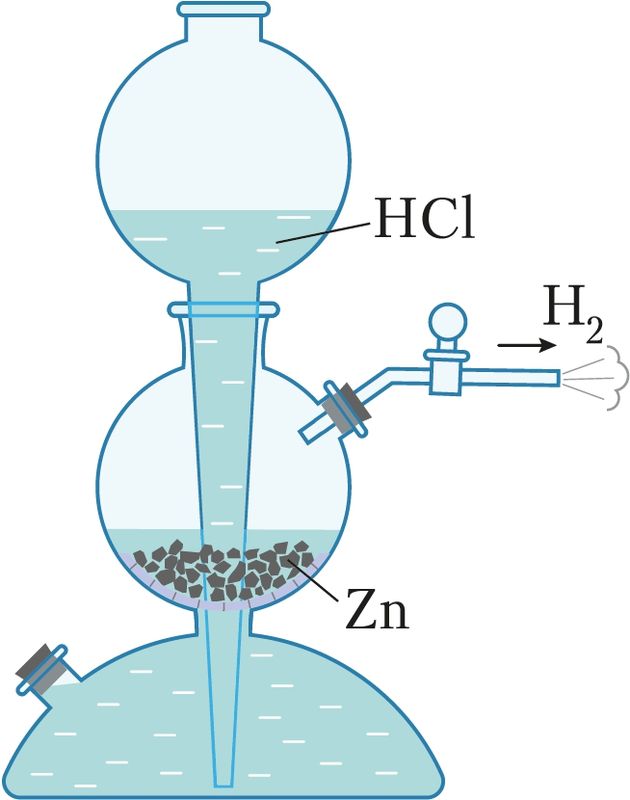
Атрыманне. Для атрымання вадароду ў лабараторыі ўжываюць металы сярэдняй актыўнасці (цынк, алюміній, жалеза) і кіслоты (хлоравадародную або серную):
Zn + 2НCl = ZnCl2 + Н2↑.
Пры гэтым часта выкарыстоўваюць апарат Кіпа — прыладу, якая дазваляе атрымліваць газападобныя рэчывы і рэгуляваць іх ток (мал. 63).
Найважнейшымі спосабамі атрымання вадароду ў прамысловасці з’яўляюцца:
1) узаемадзеянне пароў вады з метанам:
2) узаемадзеянне пароў вады з распаленым коксам:
3) электроліз вады (у прысутнасці электраліту):
Прымяненне. Адна з найважнейшых фізічных уласцівасцей вадароду — малая шчыльнасць, таму яго выкарыстоўваюць для напаўнення зондаў, якія даследуюць верхнія слаі атмасферы.
У хімічнай прамысловасці вадарод выкарыстоўваюць для атрымання аміяку NH3, хлоравадароду НСl, метанолу (СО + 2Н2 = СН3ОН), многіх металаў з іх аксідаў, напрыклад тугаплаўкіх малібдэну і вальфраму. Ужо цяпер працуюць заводы, на якіх для аднаўлення аксідаў жалеза да металу замест вугляроду (коксу) выкарыстоўваюць вадарод. Вадарод знаходзіць прымяненне ў вытворчасці маргарыну з раслінных алеяў.
Рэакцыя гарэння вадароду ў кіслародзе (2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж) выкарыстоўваецца ў ракетных рухавіках, што выводзяць у космас лятальныя апараты (мал. 64). Напрыклад, магутная касмічная ракета «Энергія» спажывала больш за 2000 тон паліва, большую частку якога складалі вадкія вадарод і кісларод. У цяперашні час пачата вытворчасць аўтамабіляў, палівам у якіх служыць вадарод (мал. 65).
Гэтую ж рэакцыю ўжываюць і для зварачных работ (мал. 66). Пры выкарыстанні спецыяльных гарэлак дасягаюць тэмпературы полымя каля 4000 °C, што дазваляе праводзіць зварачныя работы з самымі тугаплаўкімі матэрыяламі.



Вучоныя розных краін вядуць пошукі шляхоў замены на вадарод нафты, газу і вугалю як паліва. Пры згаранні апошніх утвараюцца рэчывы, якія забруджваюць і разбураюць навакольнае асяроддзе (СО2, СО, SO2 і інш.), у той час як прадуктам згарання вадароду з’яўляецца экалагічна чыстае рэчыва — вада.