§ 29. Вадарод
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 29. Вадарод |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 13 Июль 2025, 09:24 |
Вадарод як хімічны элемент

Маючы самую малую масу атама, атам вадароду мае і самую простую будову: ядро, што ўяўляе з сябе пратон, і адзін электрон, які размяшчаецца на 1s-арбіталі. Электронная канфігурацыя 1Н 1s1, электронна-графічная схема:
Электраадмоўнасць вадароду роўная 2,2. Гэта вышэй, чым у металаў, крэмнію, фосфару, але менш за электраадмоўнасць кіслароду і іншых халькагенаў, галагенаў. Таму для вадароду характэрныя ступені акіслення –1, 0 і +1, напрыклад (гідрыд літыю),
(сілан),
(метан),
(аксід вадароду, вада).
Як вы ўжо ведаеце, прыродны вадарод складаецца з двух стабільных ізатопаў — (протый — 99,98 % ад агульнага ліку атамаў),
(дэйтэрый D — 0,015 %) і радыеактыўнага
(трытый Т — следавыя колькасці) (§ 7, мал. 12).
Вадарод з’яўляецца самым распаўсюджаным элементам у Сусвеце. На Зямлі на долю вадароду па масе, лічачы ваду і паветра, прыпадае каля 1 %, а пры пераліку ад агульнага ліку атамаў — каля 17 %. Вадарод пераважна знаходзіцца ў звязаным стане. Ён уваходзіць у састаў вады, нафты, прыроднага газу, жывых арганізмаў. У выглядзе простага рэчыва вадарод амаль не сустракаецца. Следавыя колькасці яго выяўлены ў верхніх слаях атмасферы, вулканічных газах і прадуктах раскладання бактэрыямі арганічных рэчываў ва ўмовах недахопу паветра.
Вадарод як простае рэчыва
Вадарод як простае рэчыва складаецца з двухатамных малекул Н2, у якіх атамы звязаны кавалентнай адзінарнай σ-сувяззю, што ўтвараецца пры перакрыванні 1s-арбіталей:
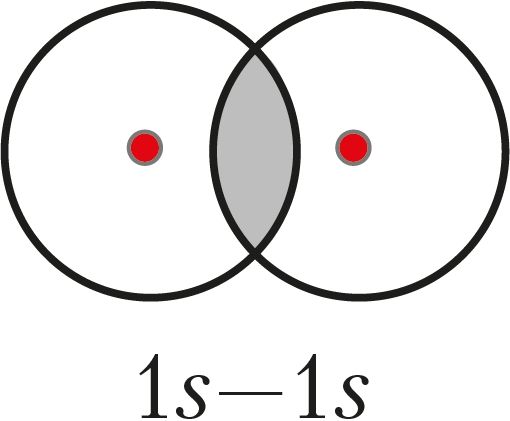
Электронная і графічная формулы малекулы маюць выгляд: Н:Н і Н—Н.
Фізічныя ўласцівасці. Вадарод пры нармальных умовах — гэта газ без колеру, паху і смаку, шчыльнасцю 0,089 г/дм3. Мае вельмі нізкія тэмпературы кіпення (–252,6 °С) і плаўлення (–259,2 °С). Растваральнасць вадароду ў вадзе як палярным растваральніку малая, таму яго можна збіраць у посуд метадам выцяснення вады. Вадарод добра раствараецца ў многіх металах (Ni, Pt, Pd і інш.).
Хімічныя ўласцівасці. Хімічная актыўнасць вадароду пры пакаёвай тэмпературы невялікая, бо высокая трываласць кавалентнай сувязі ў малекуле. У хімічных рэакцыях вадарод можа быць як адноўнікам (што больш характэрна), так і акісляльнікам.
1. Рэакцыі з простымі рэчывамі:
а) рэагуе як адноўнік з неметаламі, атамы якіх маюць у параўнанні з вадародам больш высокую электраадмоўнасць — галагенамі, азотам, серай, кіслародам:
Варта адзначыць, што вадарод не ўзаемадзейнічае з фосфарам і крэмніем;
б) рэагуе як акісляльнік са шчолачнымі і шчолачназямельнымі металамі, утвараючы гідрыды:
Гідрыды лёгка раскладаюцца вадой з вылучэннем вадароду:
2. Рэакцыі са складанымі рэчывамі:
а) узаемадзейнічае з некаторымі аксідамі металаў B-груп як адноўнік:
б) рэагуе з арганічнымі рэчывамі, якія ўтрымліваюць кратныя сувязі (рэакцыя гідрыравання) — алкенамі, алкінамі, дыенамі, арэнамі, а таксама альдэгідамі. Напрыклад:
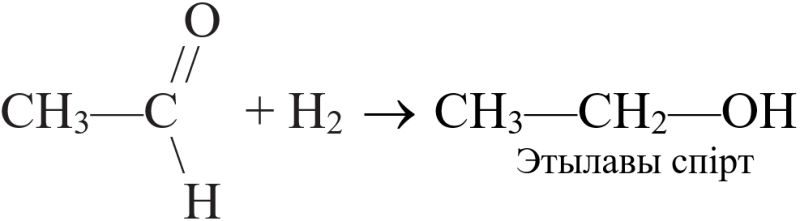
Рэагуе з трыгліцэрыдамі, якія ўтрымліваюць астаткі ненасычаных карбонавых кіслот:
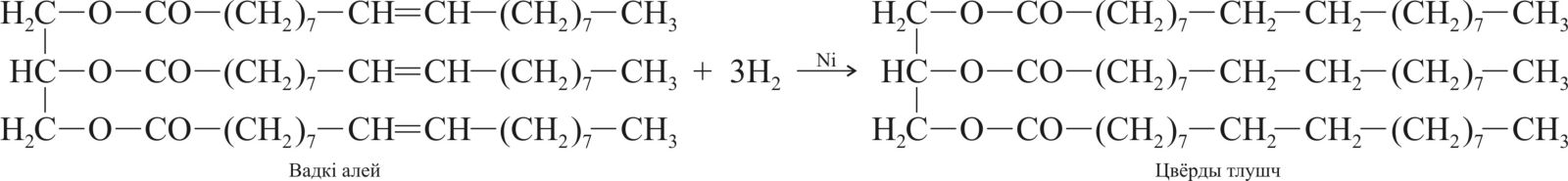
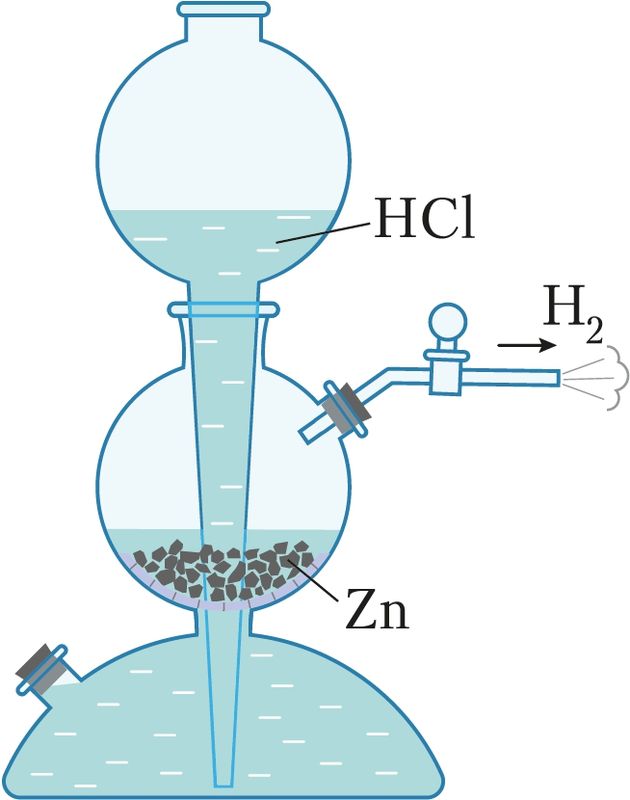
Атрыманне. Для атрымання вадароду ў лабараторыі ўжываюць металы сярэдняй актыўнасці (цынк, алюміній, жалеза) і кіслоты (хлоравадародную або серную):
Zn + 2НCl = ZnCl2 + Н2↑.
Пры гэтым часта выкарыстоўваюць апарат Кіпа — прыладу, якая дазваляе атрымліваць газападобныя рэчывы і рэгуляваць іх ток (мал. 63).
Найважнейшымі спосабамі атрымання вадароду ў прамысловасці з’яўляюцца:
1) узаемадзеянне пароў вады з метанам:
2) узаемадзеянне пароў вады з распаленым коксам:
3) электроліз вады (у прысутнасці электраліту):
Прымяненне. Адна з найважнейшых фізічных уласцівасцей вадароду — малая шчыльнасць, таму яго выкарыстоўваюць для напаўнення зондаў, якія даследуюць верхнія слаі атмасферы.
У хімічнай прамысловасці вадарод выкарыстоўваюць для атрымання аміяку NH3, хлоравадароду НСl, метанолу (СО + 2Н2 = СН3ОН), многіх металаў з іх аксідаў, напрыклад тугаплаўкіх малібдэну і вальфраму. Ужо цяпер працуюць заводы, на якіх для аднаўлення аксідаў жалеза да металу замест вугляроду (коксу) выкарыстоўваюць вадарод. Вадарод знаходзіць прымяненне ў вытворчасці маргарыну з раслінных алеяў.
Рэакцыя гарэння вадароду ў кіслародзе (2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж) выкарыстоўваецца ў ракетных рухавіках, што выводзяць у космас лятальныя апараты (мал. 64). Напрыклад, магутная касмічная ракета «Энергія» спажывала больш за 2000 тон паліва, большую частку якога складалі вадкія вадарод і кісларод. У цяперашні час пачата вытворчасць аўтамабіляў, палівам у якіх служыць вадарод (мал. 65).
Гэтую ж рэакцыю ўжываюць і для зварачных работ (мал. 66). Пры выкарыстанні спецыяльных гарэлак дасягаюць тэмпературы полымя каля 4000 °C, што дазваляе праводзіць зварачныя работы з самымі тугаплаўкімі матэрыяламі.



Вучоныя розных краін вядуць пошукі шляхоў замены на вадарод нафты, газу і вугалю як паліва. Пры згаранні апошніх утвараюцца рэчывы, якія забруджваюць і разбураюць навакольнае асяроддзе (СО2, СО, SO2 і інш.), у той час як прадуктам згарання вадароду з’яўляецца экалагічна чыстае рэчыва — вада.
Лятучыя вадародныя злучэнні
Лятучыя вадародныя злучэнні — рэчывы малекулярнай будовы, якія пры нармальных умовах уяўляюць сабой газы (НСl, NH3, H2S) або вадкасці (Н2O, НF) (мал. 67).
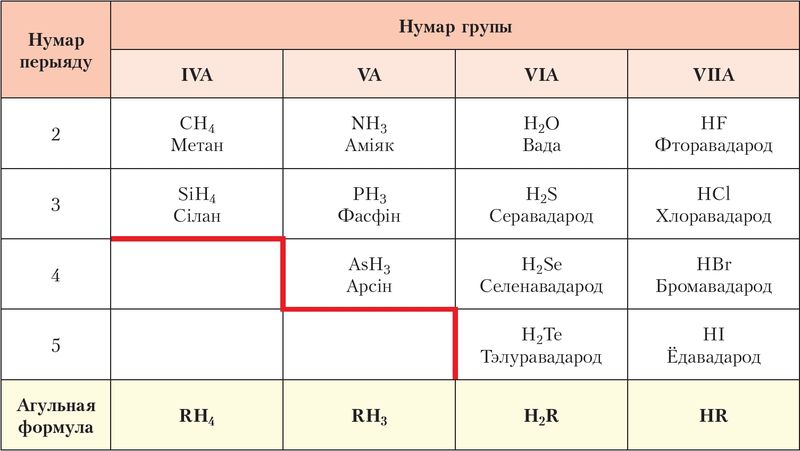
Кіслотна-асноўныя ўласцівасці водных раствораў лятучых вадародных злучэнняў змяняюцца ў залежнасці ад становішча элемента ў перыядычнай сістэме. Вядома, што СН4 не раствараецца ў вадзе, NH3 утварае слабую аснову NH3 ∙ Н2O, раствор НF — слабая, а раствор HCl — моцная кіслата:
Значыць, кіслотныя ўласцівасці вадародных злучэнняў неметалаў у перыядзе і ў групе ўзмацняюцца.
Для атама вадароду характэрны ступені акіслення –1, 0, +1. Простае рэчыва вадарод можа быць як акісляльнікам, так і адноўнікам.
Водныя растворы лятучых вадародных злучэнняў могуць праяўляць уласцівасці кіслот, асноў.
Пытанні, заданні, задачы
1. Назавіце:
- а) ізатопы вадароду;
- б) магчымыя ступені акіслення атама вадароду;
- в) групы рэчываў, з якімі можа рэагаваць вадарод;
- г) рэагенты для атрымання вадароду ў лабараторыі.
2. З прапанаванага пераліку ўраўненняў рэакцый выпішыце тыя, якія характарызуюць:
- а) уласцівасці вадароду;
- б) спосабы атрымання вадароду:
3. Запоўніце табліцу «Прымяненне вадароду».
| Уласцівасці вадароду | Сферы прымянення | Ураўненне рэакцыі |
| Рэакцыя з кіслародам | ||
| Узаемадзеянне з азотам | ||
| Узаемадзеянне з хлорам | ||
| Узаемадзеянне з аксідамі тугаплаўкіх металаў | ||
| Гідрыраванне бензолу |
4. Складзіце ўраўненні рэакцый утварэння вадароду (металы волава Sn і нікель Ni акісляюцца да ступені акіслення +2):
- а) Мg + Н2SO4 →; Sn + HCl →; НCl + Zn →;
- б) Аl + Н2SO4 →; Ni + HCl →.
5. Вызначце максімальны аб’ём вадароду (н. у.), які можа быць атрыманы ў апараце Кіпа пры загрузцы цынку масай 0,39 кг.
6. Параўнайце:
- а) састаў ядраў протыю, дэйтэрыю, трытыю;
- б) кіслотна-асноўныя ўласцівасці водных раствораў серавадароду і хлоравадароду.
7. Складзіце ўраўненні рэакцый паводле схемы:
- а)
;
- б)
.
8. Вызначце колькасць цеплаты, якая вылучылася пры згаранні вадароду аб’ёмам 1 м3 (н. у.), калі тэрмахімічнае ўраўненне рэакцыі мае выгляд: 2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж.
9. Да гідрыду невядомага двухвалентнага металу масай 1,05 г дадалі ваду ў лішку. Пры гэтым вылучыўся вадарод аб’ёмам 1,12 дм3 (н. у.). Вызначце метал.
10. У сістэме ўсталявалася раўнавага: . Вядома, што да гэтага моманту прарэагавала 35 % вадароду і ўтварылася 7 моль аміяку. Вызначце зыходную масу вадароду.
*Падрыхтуйце паведамленне «Вадарод — паліва будучыні».
*Самакантроль
1. Для атрымання вадароду ў лабараторыі выкарыстоўваюць металы:
- а) Сu;
- б) Ca;
- в) Fe;
- г) Zn.
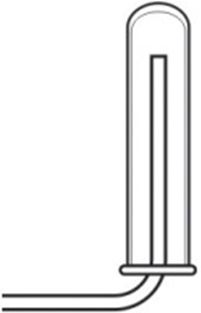
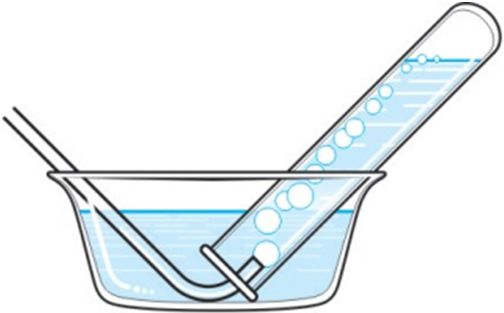
2. Для збірання вадароду без значных страт можна выкарыстоўваць пасудзіны:


3. Вадарод з’яўляецца акісляльнікам у рэакцыях з:
- а) Вa i Na;
- б) Ca i K;
- в) Fe3O4 i WO3;
- г) Li i CН2=CН2.
4. Неспрыяльныя наступствы для акаляючага асяроддзя стварае пападанне ў атмасферу:
- а) СО2;
- б) Н2О;
- в) SO2;
- г) Н2S.
5. Сума каэфіцыентаў ва ўраўненні рэакцыі поўнага аднаўлення вадародам аксіду жалеза(II,III):
- а) 4;
- б) 8;
- в) 10;
- г) 12.