§ 28. Агульная характарыстыка неметалаў
Простыя рэчывы
У класіфікацыі элементаў, што гістарычна склалася, прыналежнасць да неметалаў вызначалі па фізічных уласцівасцях простых рэчываў: цвёрды, газападобны або вадкі стан пры нармальных умовах. У цвёрдым стане ў неметалаў, як правіла, адсутнічае металічны бляск. Іх электра- і цеплаправоднасць звычайна невялікія, рэчывы з’яўляюцца крохкімі.
Неметалы ўтвараюць два тыпы крышталёў — малекулярныя і атамныя (мал. 62).
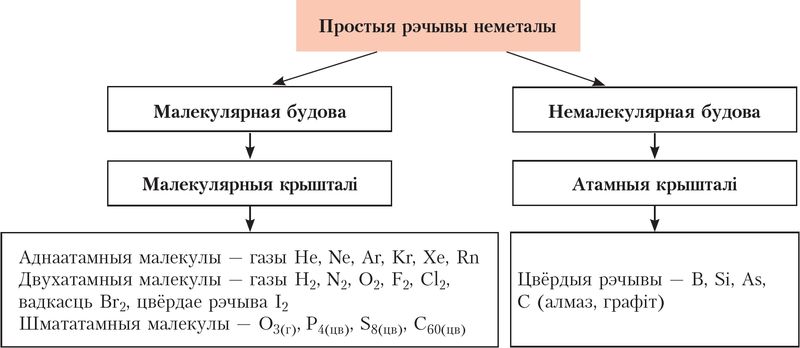
Рэчывы малекулярнай будовы адрозніваюцца нізкімі тэмпературамі плаўлення (гелій –272 °С, кісларод –223 °С) і кіпення (гелій –269 °С, кісларод –183 °С). Неметалы немалекулярнай будовы, наадварот, маюць надзвычай высокія тэмпературы кіпення і плаўлення (графіт: Tпл. = 3850 °С, Tкіп. = 4200 °С).
Для неметалаў характэрна з’ява алатропіі. Прыкладамі могуць служыць чырвоны і белы фосфар, алмаз і графіт, кісларод і азон.
Неметалы могуць уступаць у рэакцыі з рэчывамі ўсіх класаў (металамі, іншымі неметаламі, аксідамі, шчолачамі, кіслотамі, солямі) і праяўляць як акісляльныя, так і аднаўленчыя ўласцівасці (табл. 20).
Табліца 20. Агульныя ўласцівасці неметалаў як простых рэчываў
| Неметалы як акісляльнікі ўступаюць у рэакцыі | Неметалы як адноўнікі ўступаюць у рэакцыі |
| З металамі: |
З некаторымі аксідамі: |
| З іншымі неметаламі: |
З іншымі неметаламі: |
| З кіслотамі: |
З арганічнымі рэчывамі: |
| З солямі: |
Акісляльныя здольнасці атамаў неметалаў можна параўноўваць па становішчы ў перыядычнай сістэме: з ростам атамнага нумара яны павялічваюцца ў перыядах і памяншаюцца, як правіла, у групах. Гэтыя ж уласцівасці можна таксама ацэньваць, супастаўляючы электраадмоўнасць неметалаў, якая ўзрастае ў радзе:
| Si | B | As | As | H | C | I | S | Br | Cl | N | O | F |
| 1,9 | 2,0 | 2,1 | 2,2 | 2,2 | 2,5 | 2,5 | 2,6 | 2,8 | 3,0 | 3,0 | 3,5 | 4,0 |
Акісляльная здольнасць неметалаў з павелічэннем электраадмоўнасці ўзмацняецца.