§ 23. Растварэнне як фізіка-хімічны працэс
Растваральнасць рэчываў у вадзе
Як правіла, добра раствараюцца адно ў адным падобныя па фізічных і хімічных уласцівасцях рэчывы, гэта значыць дзейнічае эмпірычнае правіла «падобнае раствараецца ў падобным». Напрыклад, рэчывы, якія складаюцца з палярных малекул, і рэчывы з іонным тыпам хімічнай сувязі добра раствараюцца ў палярных растваральніках (вада, этанол). Непалярныя рэчывы добра раствараюцца ў непалярных растваральніках (бензол, талуол).
Нерастваральныя газы (напрыклад, He, Ne, H2, N2, CO) маюць растваральнасць меншую за 2 см3/100 г вады. Нерастваральнымі ў вадзе з’яўляюцца многія цвёрдыя рэчывы: аксіды (напрыклад, CuO, ZnO, Fe2O3, Cr2O3, Al2O3, SiO2), прыведзеныя ў табліцы растваральнасці са знакам Н, а таксама солі і асновы. Нерастваральныя ў вадзе вадкія і цвёрдыя алканы і цыклаалканы.
Да маларастваральных у вадзе (у табліцы растваральнасці адзначаны М) адносяцца цвёрдыя рэчывы: Ca(OH)2, LiF, BaF2, MgCO3, LiPO4, вадкія: бензол, талуол, CCl4, CHCl3, CH2Cl2, газы: Ar, Kr, Xe, O2, NO, N2O, газападобныя алканы і алкены.
Растваральнымі ў вадзе рэчывамі (у табліцы растваральнасці адзначаны Р) з’яўляюцца:
- цвёрдыя: мона- і дысахарыды, усе нітраты, ацэтаты і фарміяты; солі, утвораныя іонамі
, K+, Na+, Rb+, Cs+; H3PO4; большасць амінакіслот;
- вадкія: першыя члены гамалагічных радоў спіртоў, карбонавых кіслот, складаных эфіраў, амінаў і альдэгідаў;
- газападобныя: Cl2, галагенавадароды, SO2, H2S, CO2, HC≡CH, H2C=O (метаналь).
Раствараючы рэчыва ў вадзе, можна атрымаць насычаныя і ненасычаныя растворы.
Насычаным называюць такі раствор, у якім пры зададзенай тэмпературы рэчыва больш не раствараецца. Адпаведна, у ненасычаным растворы можна растварыць дадатковую колькасць рэчыва.
Менавіта да насычаных раствораў адносіцца колькасная характарыстыка здольнасці рэчыва да растварэння, ці растваральнасць. Растваральнасць вымяраюць, вызначаючы ўтрыманне растворанага рэчыва ў яго насычаным растворы пры зададзенай тэмпературы.
Найбольш часта выкарыстоўваюць лікавую характарыстыку — растваральнасць (s). Растваральнасць лікава роўная максімальнай масе рэчыва, здольнага пры дадзенай тэмпературы растварыцца ў 100 г растваральніку. Так, s10(KNO3) роўная 21 г/100 г вады пры 10 °С.
Растваральнасць газу вызначаюць як максімальны аб’ём газу (V, см3), які раствараецца ў 100 г растваральніку пры зададзеных тэмпературы і ціску. Часта выкарыстоўваюць такую адзінку вымярэння, як колькасць аб’ёмаў растворанага газу на адзін аб’ём вады.
Растваральнасць нярэдка вымяраюць і ў іншых велічынях, указваючы масавую долю або малярную канцэнтрацыю растворанага рэчыва ў насычаным растворы. Гэтыя ж велічыні выкарыстоўваюць для колькаснага адлюстравання саставу ненасычаных раствораў. Да гэтых велічынь вы звернецеся, вывучаючы матэрыял наступнага параграфа.
Як вам ужо вядома, рэчывы па растваральнасці ў вадзе ўмоўна дзеляць на тры групы (гл. другі форзац). Рэчыва лічаць растваральным, калі пры 20 °С раствараецца больш за 1 г рэчыва ў 100 г вады або 100 см3 у 100 г вады ў выпадку газаў. Рэчыва маларастваральнае, калі яго растваральнасць знаходзіцца ў межах ад 0,01 да 1 г у 100 г вады, і практычна нерастваральнае пры растваральнасці менш як 0,01 г у 100 г вады.
Канцэнтраваныя растворы ўтрымліваюць шмат растворанага рэчыва, а ў разбаўленых растворах канцэнтрацыя растворанага рэчыва малая. Дзяленне раствораў на канцэнтраваныя і разбаўленыя ўмоўнае. Яно не звязана з дзяленнем на насычаныя і ненасычаныя растворы. Напрыклад, насычаны раствор BaSO4 ўтрымлівае 0,0002448 г солі на 100 г вады пры 20 °С. Значыць, гэта вельмі разбаўлены раствор. Насычаны раствор KOH утрымлівае 112 г/100 г вады. Калі растварыць 80 г KOH у 100 г вады, то атрымаем канцэнтраваны, але ненасычаны раствор.
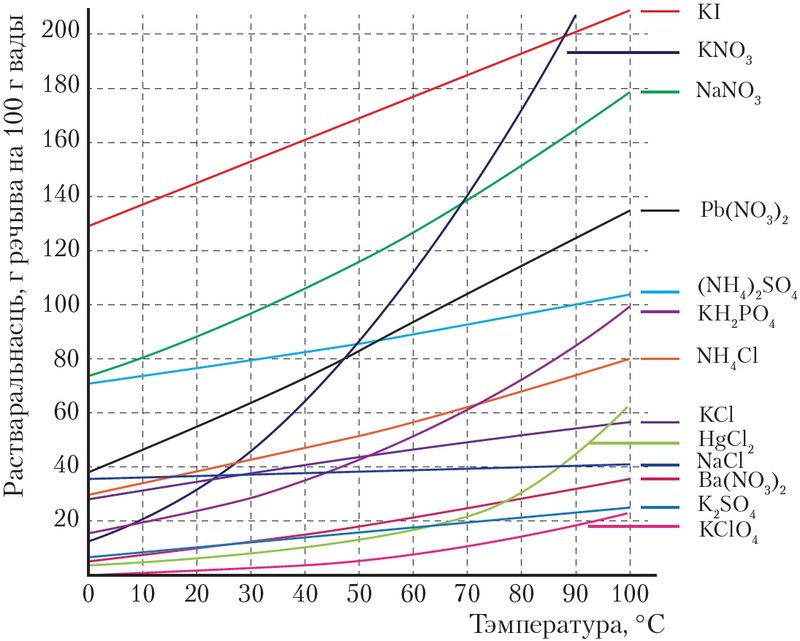
Растваральнасць цвёрдых і вадкіх рэчываў залежыць ад іх прыроды і тэмпературы раствору. З павелічэннем тэмпературы растваральнасць большасці цвёрдых рэчываў і вадкасцей прыкметна ўзрастае (мал. 51). Пры ахаладжэнні, адпаведна, растваральнасць памяншаецца і частка рэчыва выпадае ў выглядзе асадку — крышталізуецца.
Крышталізацыя адыгрывае вялікую ролю ў прыродзе: яна прыводзіць да ўтварэння многіх мінералаў, напрыклад галіту (NaCl), сільвініту (KCl), сталакцітаў і сталагмітаў (СаСО3). У прамысловасці метадам крышталізацыі вырошчваюць буйныя крышталі NaCl, LiF для аптычных прыбораў, крышталі SiO2 для ультрагукавых генератараў, мікрафонаў і інш.
Растваральнасць газаў у вадзе залежыць ад іх прыроды, тэмпературы і ціску (мал. 52, 53).
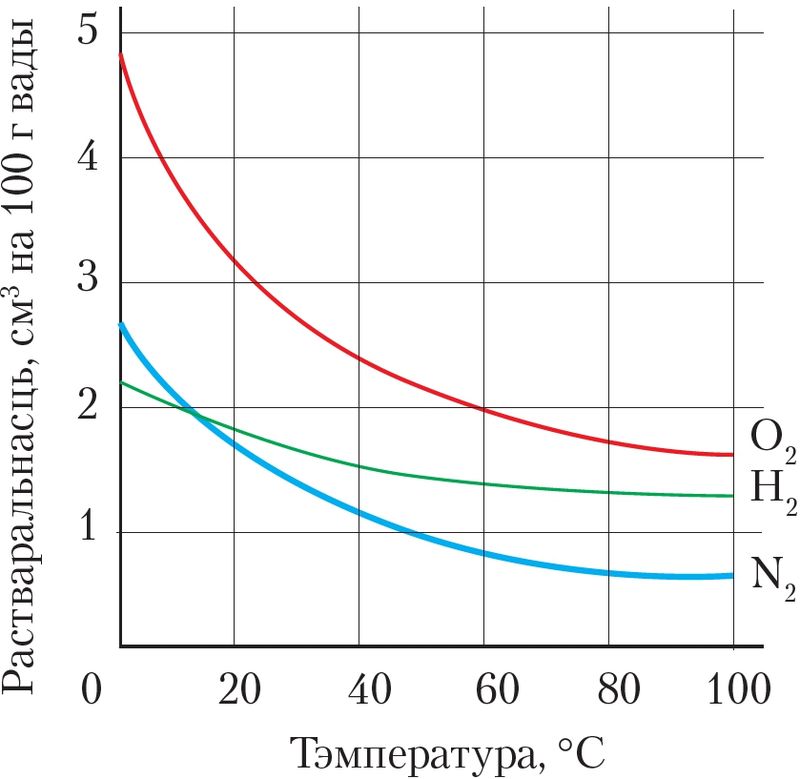
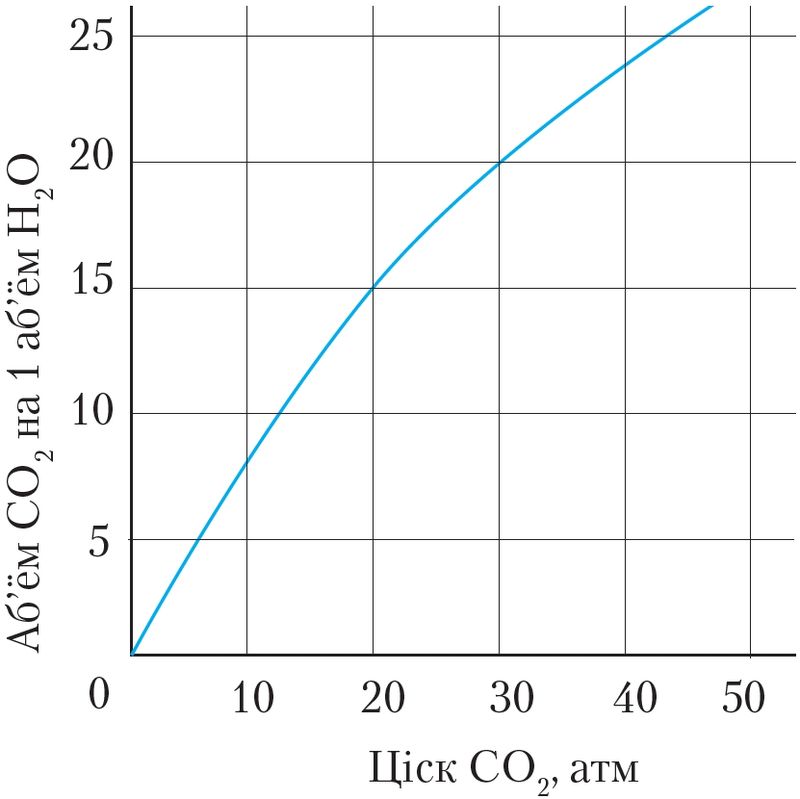
Пры растварэнні газаў вылучаецца цеплата. Пры павышэнні тэмпературы іх растваральнасць паніжаецца. Пры павелічэнні ціску растваральнась газаў павышаецца. Таму, паказваючы растваральнасць газу ў вадзе пры зададзенай тэмпературы, маюць на ўвазе растваральнасць пры яго ціску 1 атм або 101,325 кПа.
Некаторыя вадкасці, такія як H2SO4, HNO3, HF (tкіп. = 19,5 °C), CH3COOH, HCOOH, CH3OH, C2H5OH, этыленгліколь, гліцэрына, ацэтон, змешваюцца з вадой у любых суадносінах, таму гавораць пра іх неабмежаваную растваральнасць.

Па крывых растваральнасці, прыклады якіх паказаны на малюнках 51−53, можна правесці розныя разлікі. Так, можна вызначыць масу рэчыва, якое выпадае ў асадак з насычанага раствору пры яго астуджэнні. Напрыклад, па крывой растваральнасці відаць, што калі прыгатаваць насычаны пры 70 °С раствор нітрату калію ў 100 г вады, а потым астудзіць гэты раствор да 30 °С, то з яго выпадзе соль масай 140 – 50 = 90 г.
Паўторная крышталізацыя злучэнняў з іх насычанага раствору шляхам яго астуджэння або ўпарвання часткі растваральніку называецца перакрышталізацыяй і ляжыць у аснове метаду ачысткі цвёрдых рэчываў. У працэсе перакрышталізацыі растваральныя прымешкі звычайна застаюцца ў растворы і ў асадак не выпадаюць, паколькі ўтвараюць ненасычаны раствор.
Калі ў насычаны раствор рэчыва змясціць яго маленькі крышталік, то па меры выпарэння растваральніку на паверхні гэтага крышталіка будзе асаджвацца растворанае рэчыва і ўтварацца вялікі аднастайны крышталь (мал. 53.1).