§ 23. Растварэнне як фізіка-хімічны працэс
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 23. Растварэнне як фізіка-хімічны працэс |
| Напечатано:: | Гость |
| Дата: | Понедельник, 28 Июль 2025, 00:08 |
Вы ўжо знаёмыя з сумесямі рэчываў — растворамі і механічнымі сумесямі, іх класіфікацыяй (мал. 50). Нагадаем, што механічныя сумесі ўтвараюцца ў выніку простага перамешвання рэчываў без утварэння імі хімічнай сувязі або іншых хімічных змяненняў. Кожны кампанент такой механічнай (гетэрагеннай) сумесі захоўвае свой састаў і ўласцівасці.
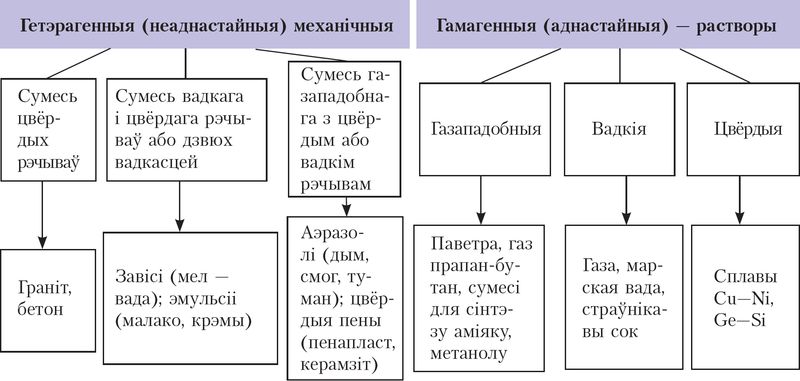
Вам таксама ўжо вядомыя растворы — гамагенныя ўстойлівыя сістэмы пераменнага саставу, якія складаюцца з некалькіх кампанентаў. Адрозніваюць вадкія (водныя і няводныя), газападобныя і цвёрдыя растворы. Некаторыя іх прыклады прыведзены на малюнку 50. Мы будзем разглядаць пераважна водныя растворы.
У адрозненне ад механічных сумесей растворы аднародныя, гэта значыць адсутнічае мяжа падзелу фаз. Акрамя таго, растворы ўстойлівыя, бо пры нязменных умовах (канцэнтрацыя растворанага рэчыва, тэмпература, ціск) яны бясконца доўга застаюцца гамагеннымі сістэмамі.
Фізіка-хімічны працэс, пры якім адбываецца ўзаемадзеянне часціц рэчыва, якое раствараецца, і растваральніка з утварэннем гамагеннай устойлівай сістэмы пераменнага саставу, называюць растварэннем.
Хімічны бок працэсу растварэння заключаецца ў разбурэнні сувязей паміж часціцамі рэчыва, якое раствараецца, і іх узаемадзеянні з малекуламі растваральніка. Пры растварэнні працякаюць фізічныя працэсы ўзаемнай дыфузіі часціц рэчыва, якое раствараецца, і малекул вады.
*Цвёрдыя, вадкія і газападобныя растворы
Растваральнік — гэта кампанент раствору, агрэгатны стан якога не змяняецца пры ўтварэнні раствору.
У вадкіх растворах і сумесях газаў растваральнік — звычайна кампанент, колькасць якога ў растворы пераважае. Тым не менш у водных растворах, незалежна ад канцэнтрацыі растворанага рэчыва, растваральнікам лічаць ваду, напрыклад раствор сернай кіслаты з масавай доляй 98 %, медыцынскі спірт з масавай доляй этанолу 97 %.
У цвёрдых рэчывах могуць быць раствораны газы, вадкасці або іншыя цвёрдыя рэчывы. Так, у металах добра раствараецца газападобны вадарод: 900 аб’ёмаў у адным аб’ёме паладыю пры 80 °С. У адным аб’ёме плаціны пры 450 °С раствараецца каля 70 аб’ёмаў кіслароду. Гэтыя цвёрдыя растворы валодаюць павышанай каталітычнай актыўнасцю ў многіх акісляльна-аднаўленчых працэсах.
Утварэнне цвёрдых раствораў высокамалекулярных злучэнняў з вадкімі пластыфікатарамі мае важнае значэнне ў хіміі палімераў. Напрыклад, у прысутнасці пластыфікатараў цвёрды полівінілхларыд, з якога робяць аконныя рамы і вінілавы сайдынг, ператвараецца ў значна больш гнуткі матэрыял, што дазваляе вырабляць з яго шлангі, абалонку электрычных кабеляў і да т. п.
Утварэнне цвёрдых раствораў адбываецца пры легіраванні металаў і іх сплаваў — дадаванні ў састаў асноўнага матэрыялу невялікіх колькасцей асаблівых прымесей для паляпшэння яго фізічных і хімічных уласцівасцей: зносаўстойлівасці, трываласці, пластычнасці, каразійнай устойлівасці. Паўправадніковыя матэрыялы на аснове цвёрдых раствораў незаменныя ў вытворчасці вырабаў электроннай тэхнікі.
Прыклад газападобнага раствору — гэта паветра, якое ўяўляе сабой сумесь газападобных кіслароду, азоту, вуглякіслага газу і высакародных газаў, пароў вады, у якой пераважае азот.
Прыкладамі вадкіх раствораў з’яўляюцца нафта — сумесь вадкіх вуглевадародаў, воцат — раствор воцатнай кіслаты ў вадзе.
Вада — самы распаўсюджаны растваральнік. Галоўнай прычынай праяўлення вадой уласцівасцей добрага растваральніку, у прыватнасці солей і малекулярных злучэнняў з палярнымі сувязямі, з’яўляецца будова яе палярных малекул, якія ўяўляюць з сябе дыполі. Растваральныя ўласцівасці вады значна ўзмацняе яе здольнасць утвараць міжмалекулярныя вадародныя сувязі з палярнымі малекуламі.
*Працэс растварэння
Такім чынам, вадкія і цвёрдыя растворы — гэта не механічная сумесь часціц растваральніку і растворанага рэчыва, а прадукт фізіка-хімічных працэсаў, у выніку якіх знікае міжфазная мяжа і ўтвараецца гамагенная сістэма.
Па меры растварэння рэчыва яго канцэнтрацыя ў растворы павышаецца, а сам працэс запавольваецца. У насычаным растворы лішак нерастворанага рэчыва знаходзіцца ў рухомай раўнавазе з растворам: скорасць растварэння часціц рэчыва роўная скорасці іх вяртання з раствору назад у зыходную фазу (газ, вадкасць або крышталь).
Паміж часціцамі растворанага рэчыва і растваральніку мае месца электрастатычнае ўзаемадзеянне. Яно рэалізуецца пры растварэнні ў вадзе электралітаў — солей, шчолачаў і іншага, калі палярныя малекулы вады звязваюцца сіламі кулонаўскага прыцягнення з катыёнамі і аніёнамі электраліту.
Міжмалекулярнае ўзаемадзеянне растворанага рэчыва і растваральніку можа адбывацца праз утварэнне вадародных сувязей, напрыклад паміж малекуламі вады і спіртоў, амінаў, аміяку і інш.
Узаемадзеянне малекул растваральніку і часціц рэчыва, якое раствараецца, вызначальнае. Так, гелій — гэта газ, які складаецца з самых маленькіх атамаў, адначасова найменш растваральны ў вадзе газ. Такім чынам, растваральнасць рэчыва — гэта не здольнасць яго часціц размяшчацца паміж малекуламі вады (ці іншага растваральніку), а здольнасць з імі ўзаемадзейнічаць.
Цеплавыя з’явы пры растварэнні
Для разрыву хімічных сувязей паміж часціцамі рэчыва, якое раствараецца, неабходна затраціць энергію. Такім чынам, колькасць цеплаты ў сістэме змяншаецца і першая стадыя растварэння — гэта эндатэрмічны працэс. Пры злучэнні часціц рэчыва, якое раствараецца, і растваральніка на другой стадыі працэсу растварэння энергія, наадварот, вылучаецца. Гэта экзатэрмічны працэс, колькасць цеплаты павялічваецца. Сумарны цеплавы эфект працэсу растварэння роўны суме дзвюх велічынь:
Q(растварэння) = –Q(разрыў хімічных сувязей) + Q(утварэнне хімічных сувязей).
Эксперыментальныя даныя паказваюць, што пры растварэнні цвёрдых рэчываў у адных выпадках цеплата вылучаецца, а ў другіх — паглынаецца. Напрыклад, пры растварэнні ў вадзе нітрату амонію NH4NO3 назіраецца моцнае ахаладжэнне раствору. Прычына заключаецца ў тым, што колькасць цеплаты, якая вылучаецца пры ўзаемадзеянні катыёнаў і аніёнаў
з малекуламі 128 Хімія раствораў вады, меншая за колькасць цеплаты, што затрачваецца на разрыў іонных сувязей у крышталях нітрату амонію (Q(растварэння) = –26,4 кДж/моль). Другі прыклад — растварэнне ў вадзе гідраксіду калію, якое суправаджаецца моцным разаграваннем раствору. У гэтым выпадку энергія, якая вылучаецца пры ўзаемадзеянні іонаў K+ і OH– з малекуламі вады, большая за энергію, што затрачваецца на разрыў сувязей паміж гэтымі іонамі ў крышталічным KOH (Q(растварэння) = + 55,6 кДж/моль).
Растварэнне газаў і вадкасцей у вадзе звычайна суправаджаецца вылучэннем цеплаты, бо практычна адсутнічаюць затраты энергіі на разбурэнне сувязей паміж малекуламі зыходнага рэчыва.
Растваральнасць рэчываў у вадзе
Як правіла, добра раствараюцца адно ў адным падобныя па фізічных і хімічных уласцівасцях рэчывы, гэта значыць дзейнічае эмпірычнае правіла «падобнае раствараецца ў падобным». Напрыклад, рэчывы, якія складаюцца з палярных малекул, і рэчывы з іонным тыпам хімічнай сувязі добра раствараюцца ў палярных растваральніках (вада, этанол). Непалярныя рэчывы добра раствараюцца ў непалярных растваральніках (бензол, талуол).
Нерастваральныя газы (напрыклад, He, Ne, H2, N2, CO) маюць растваральнасць меншую за 2 см3/100 г вады. Нерастваральнымі ў вадзе з’яўляюцца многія цвёрдыя рэчывы: аксіды (напрыклад, CuO, ZnO, Fe2O3, Cr2O3, Al2O3, SiO2), прыведзеныя ў табліцы растваральнасці са знакам Н, а таксама солі і асновы. Нерастваральныя ў вадзе вадкія і цвёрдыя алканы і цыклаалканы.
Да маларастваральных у вадзе (у табліцы растваральнасці адзначаны М) адносяцца цвёрдыя рэчывы: Ca(OH)2, LiF, BaF2, MgCO3, LiPO4, вадкія: бензол, талуол, CCl4, CHCl3, CH2Cl2, газы: Ar, Kr, Xe, O2, NO, N2O, газападобныя алканы і алкены.
Растваральнымі ў вадзе рэчывамі (у табліцы растваральнасці адзначаны Р) з’яўляюцца:
- цвёрдыя: мона- і дысахарыды, усе нітраты, ацэтаты і фарміяты; солі, утвораныя іонамі
, K+, Na+, Rb+, Cs+; H3PO4; большасць амінакіслот;
- вадкія: першыя члены гамалагічных радоў спіртоў, карбонавых кіслот, складаных эфіраў, амінаў і альдэгідаў;
- газападобныя: Cl2, галагенавадароды, SO2, H2S, CO2, HC≡CH, H2C=O (метаналь).
Раствараючы рэчыва ў вадзе, можна атрымаць насычаныя і ненасычаныя растворы.
Насычаным называюць такі раствор, у якім пры зададзенай тэмпературы рэчыва больш не раствараецца. Адпаведна, у ненасычаным растворы можна растварыць дадатковую колькасць рэчыва.
Менавіта да насычаных раствораў адносіцца колькасная характарыстыка здольнасці рэчыва да растварэння, ці растваральнасць. Растваральнасць вымяраюць, вызначаючы ўтрыманне растворанага рэчыва ў яго насычаным растворы пры зададзенай тэмпературы.
Найбольш часта выкарыстоўваюць лікавую характарыстыку — растваральнасць (s). Растваральнасць лікава роўная максімальнай масе рэчыва, здольнага пры дадзенай тэмпературы растварыцца ў 100 г растваральніку. Так, s10(KNO3) роўная 21 г/100 г вады пры 10 °С.
Растваральнасць газу вызначаюць як максімальны аб’ём газу (V, см3), які раствараецца ў 100 г растваральніку пры зададзеных тэмпературы і ціску. Часта выкарыстоўваюць такую адзінку вымярэння, як колькасць аб’ёмаў растворанага газу на адзін аб’ём вады.
Растваральнасць нярэдка вымяраюць і ў іншых велічынях, указваючы масавую долю або малярную канцэнтрацыю растворанага рэчыва ў насычаным растворы. Гэтыя ж велічыні выкарыстоўваюць для колькаснага адлюстравання саставу ненасычаных раствораў. Да гэтых велічынь вы звернецеся, вывучаючы матэрыял наступнага параграфа.
Як вам ужо вядома, рэчывы па растваральнасці ў вадзе ўмоўна дзеляць на тры групы (гл. другі форзац). Рэчыва лічаць растваральным, калі пры 20 °С раствараецца больш за 1 г рэчыва ў 100 г вады або 100 см3 у 100 г вады ў выпадку газаў. Рэчыва маларастваральнае, калі яго растваральнасць знаходзіцца ў межах ад 0,01 да 1 г у 100 г вады, і практычна нерастваральнае пры растваральнасці менш як 0,01 г у 100 г вады.
Канцэнтраваныя растворы ўтрымліваюць шмат растворанага рэчыва, а ў разбаўленых растворах канцэнтрацыя растворанага рэчыва малая. Дзяленне раствораў на канцэнтраваныя і разбаўленыя ўмоўнае. Яно не звязана з дзяленнем на насычаныя і ненасычаныя растворы. Напрыклад, насычаны раствор BaSO4 ўтрымлівае 0,0002448 г солі на 100 г вады пры 20 °С. Значыць, гэта вельмі разбаўлены раствор. Насычаны раствор KOH утрымлівае 112 г/100 г вады. Калі растварыць 80 г KOH у 100 г вады, то атрымаем канцэнтраваны, але ненасычаны раствор.
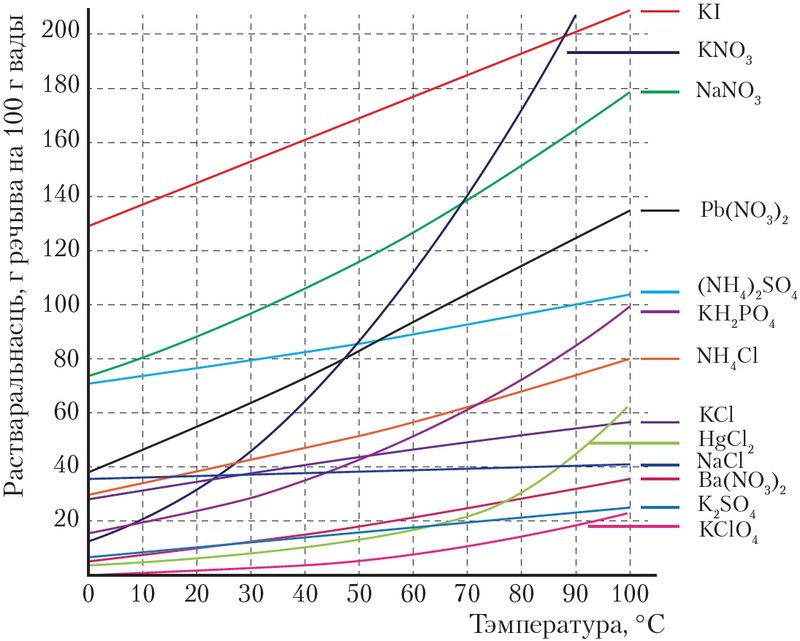
Растваральнасць цвёрдых і вадкіх рэчываў залежыць ад іх прыроды і тэмпературы раствору. З павелічэннем тэмпературы растваральнасць большасці цвёрдых рэчываў і вадкасцей прыкметна ўзрастае (мал. 51). Пры ахаладжэнні, адпаведна, растваральнасць памяншаецца і частка рэчыва выпадае ў выглядзе асадку — крышталізуецца.
Крышталізацыя адыгрывае вялікую ролю ў прыродзе: яна прыводзіць да ўтварэння многіх мінералаў, напрыклад галіту (NaCl), сільвініту (KCl), сталакцітаў і сталагмітаў (СаСО3). У прамысловасці метадам крышталізацыі вырошчваюць буйныя крышталі NaCl, LiF для аптычных прыбораў, крышталі SiO2 для ультрагукавых генератараў, мікрафонаў і інш.
Растваральнасць газаў у вадзе залежыць ад іх прыроды, тэмпературы і ціску (мал. 52, 53).
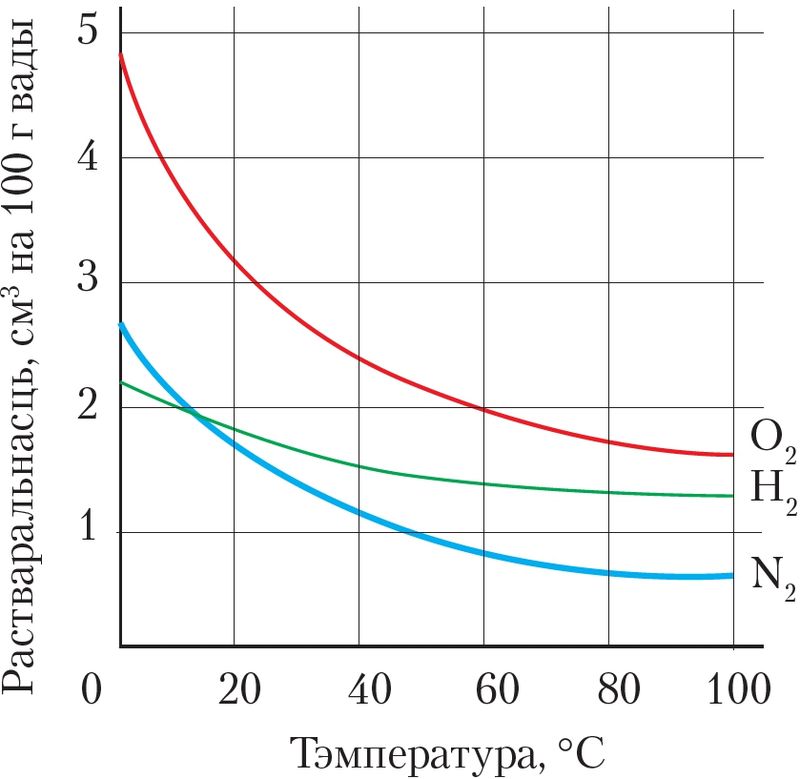
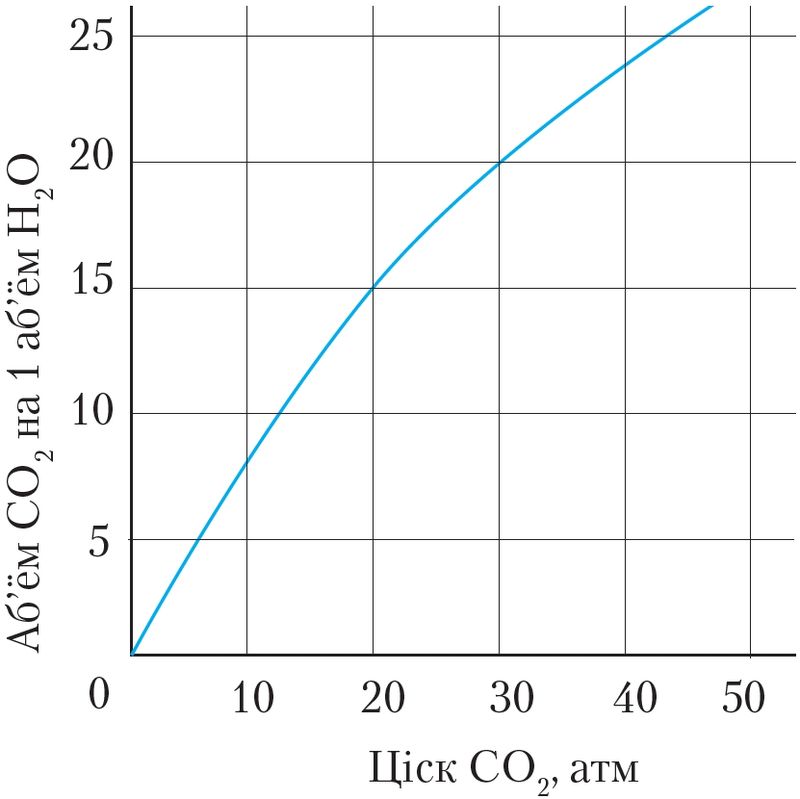
Пры растварэнні газаў вылучаецца цеплата. Пры павышэнні тэмпературы іх растваральнасць паніжаецца. Пры павелічэнні ціску растваральнась газаў павышаецца. Таму, паказваючы растваральнасць газу ў вадзе пры зададзенай тэмпературы, маюць на ўвазе растваральнасць пры яго ціску 1 атм або 101,325 кПа.
Некаторыя вадкасці, такія як H2SO4, HNO3, HF (tкіп. = 19,5 °C), CH3COOH, HCOOH, CH3OH, C2H5OH, этыленгліколь, гліцэрына, ацэтон, змешваюцца з вадой у любых суадносінах, таму гавораць пра іх неабмежаваную растваральнасць.

Па крывых растваральнасці, прыклады якіх паказаны на малюнках 51−53, можна правесці розныя разлікі. Так, можна вызначыць масу рэчыва, якое выпадае ў асадак з насычанага раствору пры яго астуджэнні. Напрыклад, па крывой растваральнасці відаць, што калі прыгатаваць насычаны пры 70 °С раствор нітрату калію ў 100 г вады, а потым астудзіць гэты раствор да 30 °С, то з яго выпадзе соль масай 140 – 50 = 90 г.
Паўторная крышталізацыя злучэнняў з іх насычанага раствору шляхам яго астуджэння або ўпарвання часткі растваральніку называецца перакрышталізацыяй і ляжыць у аснове метаду ачысткі цвёрдых рэчываў. У працэсе перакрышталізацыі растваральныя прымешкі звычайна застаюцца ў растворы і ў асадак не выпадаюць, паколькі ўтвараюць ненасычаны раствор.
Калі ў насычаны раствор рэчыва змясціць яго маленькі крышталік, то па меры выпарэння растваральніку на паверхні гэтага крышталіка будзе асаджвацца растворанае рэчыва і ўтварацца вялікі аднастайны крышталь (мал. 53.1).
Гідраты і крышталегідраты
У шэрагу выпадкаў у выніку фізіка-хімічнага ўзаемадзеяння часціц растворанага рэчыва з вадой утвараюцца злучэнні — гідраты. Такі працэс называюць гідратацыяй. Малекулы вады пры гэтым не разбураюцца, а звязваюцца з малекуламі або іонамі растворанага рэчыва.
Гідраты — гэта прадукты далучэння вады да неарганічных і арганічных рэчываў, у якіх малекула вады прысутнічае ў выглядзе асобнай структурнай адзінкі.
Многія гідраты лёгка распадаюцца, хоць могуць утвараць і ўстойлівыя злучэнні. У шэрагу выпадкаў пасля ўпарвання растваральніку і крышталізацыі растворанага злучэння можна вылучыць крышталегідраты.
Большасць крышталегідратаў з’яўляюцца солямі. Крышталегідраты ўтвараюцца, калі ў крышталічнай рашотцы катыёны звязваюцца з малекуламі вады больш трывала, чым з аніёнамі ў крышталях бязводнай солі. Састаў крышталегідрату адлюстроўваюць формулай, якая паказвае колькасць малекул крышталізацыйнай вады на адну структурную адзінку рэчыва, напрыклад крышталічная сода Na2CO3 · 10H2O, гіпс CaSO4 · 2H2O, медны купарвас CuSO4 · 5H2O. З гэтымі крышталегідратамі вы ўжо знаёмыя з курсаў хіміі 8-га і 9-га класаў.
Часам крышталегідраты ўтвараюць кіслоты (шчаўевая, лімонная), асновы (KOH · 2H2O, NaOH · H2O, Ba(OH)2 · 8H2O), а таксама некаторыя вуглевадароды (глюкоза) і іх вытворныя (сарбіт).
Крышталегідраты — гэта крышталічныя прадукты далучэння вады да неарганічных і арганічных рэчываў, якія маюць пэўны састаў і ўключаюць малекулы вады ў выглядзе асобнай структурнай адзінкі. Вада, якая ўваходзіць у склад крышталегідратаў, называецца крышталізацыйнай.
Многія крышталегідраты ярка афарбаваны. Напрыклад, бязводны CoCl2 мае сіні колер. У выніку гідратацыі ён ператвараецца ў цёмна-ружовы крышталегідрат CoCl2 · 6H2O (мал. 54, а) і таму можа выкарыстоўвацца ў якасці індыкатару прысутнасці вады. Аналагічную ролю можа выконваць і сульфат медзі(II): бязводны CuSO4 — бледна-блакітны, крышталегідрат CuSO4 · 5H2O — ярка-сіні (мал. 54, б).

Працэс утварэння крышталегідратаў выкарыстоўваецца ў будаўніцтве. Так, парашок цэменту ў асноўным складаецца з сумесі бязводных крышталёў 3CaO · SiO2 і 2CaO · SiO2. Пры змешванні цэменту з вадой працякаюць працэсы гідратацыі і ўтварэння крышталегідратаў 3CaO · SiO2 · 3H2O і 2CaO · SiO2 · 3H2O. Пры гэтым пластычны цэментавы клей, які нагадвае па кансістэнцыі цеста, цвярдзее і ператвараецца ў цэментавы камень.
Малекулы вады ў гідратах звязваюцца з малекуламі або іонамі растворанага рэчыва за кошт донарна-акцэптарнага, электрастатычнага ўзаемадзеяння або ўтварэння вадародных сувязей.
У гідратах малекулы або іоны растворанага рэчыва аказваюцца акружанымі больш ці менш цесна звязанымі з імі малекуламі вады, колькасць якіх можа змяняцца.
Гідратную тэорыю раствораў прапанаваў Д. І. Мендзялееў. Ён пісаў: «Растворы — гэта хімічныя злучэнні, якія вызначаюцца сіламі, што дзейнічаюць паміж растваральнікам і раствораным целам».
Той факт, што ўтварэнне раствораў у значнай ступені з’яўляецца хімічным узаемадзеяннем, пацвярджаецца не толькі вылучэннем або паглынаннем цеплаты пры растварэнні, але і памяншэннем аб’ёму раствору ў параўнанні з зыходным сумарным аб’ёмам яго кампанентаў. Напрыклад, пры змешванні 50 мл этанолу з 50 мл вады ўтвараецца 97 мл раствору. Раствор пры гэтым крыху награваецца.
У табліцы 15.1 прыведзены прыклады найбольш распаўсюджаных крышталегідратаў.
Табліца 15.1. Формулы, знешні выгляд і назвы крышталегідратаў
| Назва крышталегідрату | Хімічная формула | Знешні выгляд |
|---|---|---|
| Крышталічная сода, дэкагідрат карбанату натрыю | Na2CO3 · 10H2O |
 |
| Медны купарвас, пентагідрат сульфату медзі(II) | CuSO4 · 5H2O |
 |
| Жалезны купарвас, гептагідрат сульфату жалеза(II) | FeSO4 · 7H2O |
 |
| Цынкавы купарвас, гептагідрат сульфату цынку(II) | ZnSO4 · 7H2O |
 |
| Глаўберава соль, дэкагідрат сульфату натрыю | Na2SO4 · 10H2O |
 |
| Гіпс, дыгідрат сульфату кальцыю | CaSO4 · 2H2O |
 |
Растворы — гамагенныя ўстойлівыя сістэмы пераменнага саставу, якія складаюцца з некалькіх кампанентаў.
Растварэнне — гэта фізіка-хімічны працэс, які суправаджаецца вылучэннем або паглынаннем цеплаты.
Растваральнасць рэчываў залежыць ад іх прыроды і тэмпературы. На растваральнасць газаў уплывае ціск.
Крышталегідраты — гэта крышталічныя прадукты далучэння вады да неарганічных і арганічных рэчываў, якія маюць пэўны састаў і ўключаюць малекулы вады ў выглядзе асобнай структурнай адзінкі.
Пытанні, заданні, задачы
1. Прывядзіце прыклады цвёрдых, вадкіх і газападобных раствораў. Пакажыце вобласці прымянення цвёрдых раствораў.
2. Назавіце асноўныя адрозненні паміж растворам і механічнай сумессю рэчываў.
3. Карыстаючыся данымі табліцы растваральнасці на форзацы падручніка, прывядзіце па два прыклады:
- а) растваральных;
- б) маларастваральных;
- в) практычна нерастваральных у вадзе злучэнняў.
Запішыце іх формулы.
4. Дадзены злучэнні: хлоравадарод, нітрат калію, хларыд калію, хларыд натрыю, аксід серы(IV), аміяк. З дапамогай крывых растваральнасці (мал. 51), а таксама ведаў аб растваральнасці газаў вызначце рэчывы, растваральнасць якіх у вадзе пры павышэнні тэмпературы:
- а) узрастае;
- б) застаецца практычна нязменнай;
- в) памяншаецца.
5. Назавіце працэсы ўзаемадзеяння паміж малекуламі вады і рэчывам, якое раствараецца, пры ўтварэнні воднага раствору.
6. Па крывых растваральнасці (мал. 51) знайдзіце растваральнасць солей: нітрату натрыю, хларыду амонію і хларыду натрыю пры 20 °С, 50 °С, 70 °С.
7. Растваральнасць натрыевай салетры NaNO3 пры 10 °С роўная 80 г на 100 г вады. Вызначце масавую долю солі ў насычаным растворы пры гэтай тэмпературы.
8. Масавая доля KNO3 ў насычаным пры 20 °С растворы роўная 24,0 %. Вызначце растваральнасць KNO3 пры 20 °С (г/100 г вады).
9. Разлічыце, на колькі грамаў адрозніваецца маса 500 г бязводнага сульфату кальцыю і яго двухводнага крышталегідрату (гіпсу).
10. Растваральнасць аміяку пры 0 °С роўная 1153 аб’ёмы на 1 аб’ём вады, а пры 30 °С — 532 аб’ёмы (пры н. у.) на 1 аб’ём вады. Насычаны пры 0 °С раствор масай 250 г нагрэлі да 30 °С. Як змянілася яго маса? Які аб’ём (пры н. у.) аміяку вылучыўся пры награванні? Адказ пацвердзіце разлікам.
*Самакантроль
1. Працэс растварэння NaCl у вадзе суправаджаецца:
- а) раўнамерным размеркаваннем часціц солі ў вадзе;
- б) хімічнай рэакцыяй паміж раствораным рэчывам і растваральнікам;
- в) узаемадзеяннем часціц растворанага рэчыва з малекуламі растваральніку з утварэннем гідратаў;
- г) разбурэннем крышталічнай структуры солі.
2. Дэкагідрату сульфату натрыю адпавядае формула:
- а) Na2SO4;
- б) NaHSO4;
- в) Na2SO4 ∙ 10H2O;
- г) Na2SO4 ∙ 7H2O.
3. Да раствору адносяцца сістэмы:
- а) Н2О — мел;
- б) Н2О — сода;
- в) H2O — вуглякіслы газ;
- г) CaSO4 ∙ 2H2O.
4. Растваральнасць газу ў вадзе можна павялічыць:
- а) павялічваючы тэмпературу растваральніку;
- б) павышаючы ціск газу;
- в) перамешваючы раствор;
- г) паніжаючы тэмпературу растваральніку.
5. Растваральнасць нітрату калію s10(KNO3) = 60 г/100 г вады. Яго раствор з масавай доляй 0,375 з’яўляецца:
- а) насычаным;
- б) разбаўленым;
- в) канцэнтраваным;
- г) ненасычаным.