§ 32. Элементы VIА-группы. Кислород и сера
Кислород как простое вещество
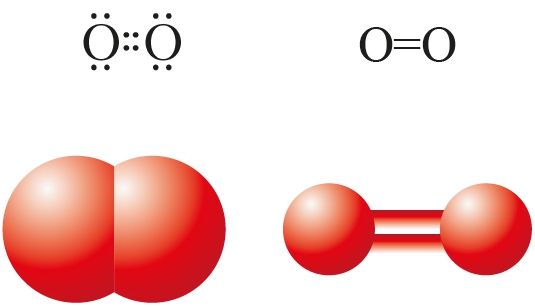
и структурная
формулы, масштабная
и шаростержневая
модели молекулы
кислорода
Кислород существует в природе в виде двух простых веществ (аллотропных модификаций) молекулярного строения — кислорода О2 и озона О3. В молекуле кислорода существует двойная ковалентная неполярная связь (рис. 29, 72).
Физические свойства кислорода. Кислород мало растворим в воде: при 20 °С в 1 дм3 воды растворяется 31 см3 кислорода. Тем не менее этого хватает для дыхания рыб в водоёмах. Жидкий кислород — подвижная, слегка голубоватая жидкость, кипящая при температуре –183 °С. Твёрдый кислород представляет собой синие кристаллы, плавящиеся при ещё более низкой температуре –219 °С.
Химические свойства кислорода. Кислород во всех реакциях, кроме взаимодействия со фтором, проявляет свойства окислителя. При окислении кислородом простых и сложных веществ образуются, как правило, оксиды.
1. Кислород взаимодействует с металлами:
Он окисляет практически все металлы, кроме серебра, золота и платины. С активными металлами кислород может образовывать не только оксиды, но и пероксиды (Na2O2), надпероксиды (KО2) или другие бинарные соединения.
2. Реагируя с неметаллами, кислород образует кислотные или несолеобразующие оксиды:
С хлором, бромом и йодом кислород не реагирует.
3. Кислород окисляет сложные неорганические и органические вещества:
При этом отметим, что горение углеводородов используют как источник тепловой энергии:
CH4(г) + 2O2(г) = CO2(г) + 2H2O(ж)+ 891 кДж.
В органическом синтезе кислород широко применяется в реакциях каталитического окисления: