§ 32. Элементы VIА-группы. Кислород и сера
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 32. Элементы VIА-группы. Кислород и сера |
| Напечатано:: | Гость |
| Дата: | Tuesday, 21 October 2025, 10:56 |
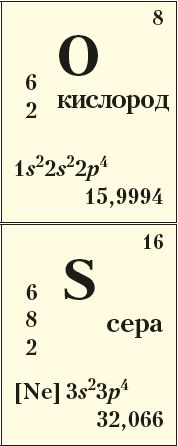
Кислород и сера как химические элементы
Элементы VIА-группы кислород 8О, сера 16S, селен 34Se и теллур 52Те имеют общее название халькогены, что в переводе означает «рождающие руду». Действительно, подавляющее число природных минералов содержит кислород либо серу, например магнетит Fe3O4, халькопирит CuFeS2.
Как вам известно, кислород — самый распространённый элемент на Земле, он составляет 49 % от массы земной коры.
Сера — шестнадцатый по распространённости элемент, встречается как в виде соединений, так и в самородном состоянии (табл. 26).
Таблица 26. Химические элементы халькогены
| Элемент | Радиус атома, нм | χ | Степени окисления | Природные соединения |
| Кислород 8О | 0,073 | 3,5 | –2, –1, 0, +2 | О2, О3, H2O, минералы, органические соединения |
| Сера 16S | 0,104 | 2,6 | –2, –1, 0, +4, +6 | Сера самородная S, медный колчедан (халькопирит) СuFеS2, железный колчедан (пирит) FeS2, глауберова соль Na2SO4 · 10H2O, белки |
| Селен 34Se | 0,117 | 2,5 | –2, 0, +4, +6 | Селен самородный Se (встречается изредка), соединения с железом, свинцом, ртутью (селениды) в сульфидных месторождениях, органические соединения — селенобелки |
| Теллур 52Te | 0,137 | 2,1 | –2, 0, +4, +6 | Теллур самородный Те (в месторождениях серы и селена), соединения с медью, свинцом, цинком, серебром, золотом (теллуриды) в месторождениях соответствующих металлов |
На внешнем электронном слое, общая конфигурация которого ns2np4, атомы халькогенов имеют по 6 электронов, из которых два неспаренных на р-подуровне (Приложение 1):

Из приведённых электронных конфигураций внешнего электронного слоя атомов кислорода, серы следует, что низшая степень окисления этих халькогенов –2. Сера проявляет положительные степени окисления +4, +6 при возбуждении s- и p-электронов внешнего слоя на d-подуровень. Сера по электроотрицательности уступает галогенам (кроме йода), азоту и кислороду. Кислород, будучи вторым после фтора по электроотрицательности, проявляет положительную степень окисления +2 только в соединении со фтором .
Неприятные запахи, ощущаемые при гниении трупов животных, можно объяснить выделением соединений серы (меркаптанов и сероводорода), которые образуются при разложении белков.
Кислород как простое вещество
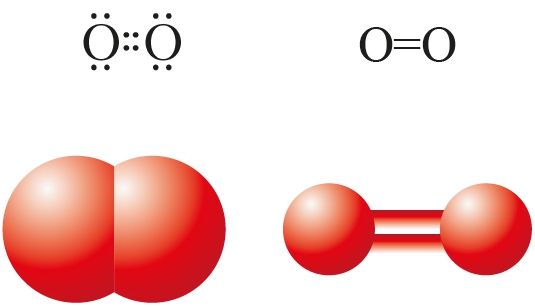
и структурная
формулы, масштабная
и шаростержневая
модели молекулы
кислорода
Кислород существует в природе в виде двух простых веществ (аллотропных модификаций) молекулярного строения — кислорода О2 и озона О3. В молекуле кислорода существует двойная ковалентная неполярная связь (рис. 29, 72).
Физические свойства кислорода. Кислород мало растворим в воде: при 20 °С в 1 дм3 воды растворяется 31 см3 кислорода. Тем не менее этого хватает для дыхания рыб в водоёмах. Жидкий кислород — подвижная, слегка голубоватая жидкость, кипящая при температуре –183 °С. Твёрдый кислород представляет собой синие кристаллы, плавящиеся при ещё более низкой температуре –219 °С.
Химические свойства кислорода. Кислород во всех реакциях, кроме взаимодействия со фтором, проявляет свойства окислителя. При окислении кислородом простых и сложных веществ образуются, как правило, оксиды.
1. Кислород взаимодействует с металлами:
Он окисляет практически все металлы, кроме серебра, золота и платины. С активными металлами кислород может образовывать не только оксиды, но и пероксиды (Na2O2), надпероксиды (KО2) или другие бинарные соединения.
2. Реагируя с неметаллами, кислород образует кислотные или несолеобразующие оксиды:
С хлором, бромом и йодом кислород не реагирует.
3. Кислород окисляет сложные неорганические и органические вещества:
При этом отметим, что горение углеводородов используют как источник тепловой энергии:
CH4(г) + 2O2(г) = CO2(г) + 2H2O(ж)+ 891 кДж.
В органическом синтезе кислород широко применяется в реакциях каталитического окисления:

в баллонах и газометре
Получение кислорода
В промышленности кислород получают разделением жидкого воздуха, небольшие порции хранят в баллонах голубого цвета, а в лабораториях — в газометрах (рис. 73). Важнейшим лабораторным способом его получения служит разложение некоторых кислородсодержащих веществ — перманганата калия, бертолетовой соли, воды, пероксида водорода:
В сосуды кислород собирают методом вытеснения воды или воздуха (рис. 74).
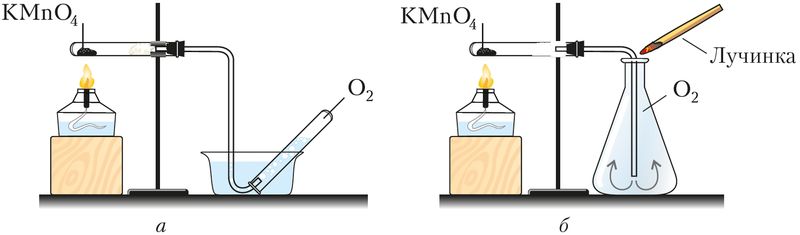
методом: а — вытеснением воды, б — вытеснением воздуха
Озон
Озон — газ с резким запахом, имеет бледно-голубой цвет, в жидком состоянии — синий. В процессе реакций озон распадается с образованием атомарного кислорода:
О3 = О2 + О,
поэтому по сравнению с кислородом обладает большей химической активностью. В природе озон образуется из атмосферного кислорода при грозовых разрядах, а на высоте 10–30 км — под действием ультрафиолетового излучения. Озоновый слой над поверхностью Земли задерживает коротковолновое ультрафиолетовое излучение Солнца, вредное для живых организмов.
Озон образуется при работе лазерных принтеров, источников рентгеновского и ультрафиолетового излучения. Предельно допустимая концентрация (ПДК) озона в воздухе рабочей зоны составляет 0,1 мг/м3. Характерный запах озона начинает ощущаться уже при концентрациях 0,004–0,010 мг/м3, то есть во много раз ниже гигиенического норматива, что важно для персонала, работающего с озоном.
Воду обеззараживают хлорированием или озонированием. Озонирование воды более безопасно для человеческого организма, чем хлорирование.
Сера
Состав и строение молекулы серы. Молекулы кристаллической серы имеют форму замкнутых циклов. Если расплавленную серу вылить в стакан с холодной водой (быстро охладить), то образуется пластическая сера. Её молекулы представляют собой длинные цепи (рис. 75). Пластическая сера неустойчива и уже через несколько часов после получения превращается в жёлтые кристаллы ромбической серы как наиболее устойчивой из аллотропных модификаций.

а — молекулы S8, б — цепи атомов пластической серы, в — кристаллы ромбической серы, г — кристаллы моноклинной серы, д — пластическая сера
Известно несколько аллотропных модификаций серы: две кристаллические — моноклинная S8 (Tпл.= 119,3 °С) и ромбическая S8 (Tпл.= 112,8 °С), а также пластическая S∞ (рис. 75). Наиболее устойчива при комнатной температуре ромбическая сера.
Химические свойства. Сера — достаточно активный неметалл. При нагревании легко окисляется кислородом и галогенами, реагирует как окислитель с водородом и металлами (кроме золота и платины):
| Сера как восстановитель | Сера как окислитель |
Применение кислорода и серы. Наиболее значимые области применения кислорода и серы указаны в таблице 27.
Таблица 27. Области применения кислорода, озона и серы
| О2 | Сварка и резка металлов. Окислитель ракетного топлива. Дыхательные смеси — космос, подводные лодки, медицина. Химическая промышленность — получение оксидов, кислот и др. Органический синтез — альдегиды, карбоновые кислоты. Металлургия |
| О3 | Отбеливающее средство. Дезинфицирующее средство в медицине. Обеззараживание питьевой воды и сточных вод |
| S | Производство серной кислоты. Производство резины. Производство спичек. Производство красителей, пигментов |
Кислород нашёл применение в дыхательных аппаратах (рис. 76).
искусственной вентиляции
лёгких (ИВЛ)
Электронная конфигурация валентного слоя халькогенов ns2np4. Низшая степень их окисления –2.
Кислород как окислитель реагирует с простыми и сложными веществами, образуя, как правило, оксиды.
Сера является окислителем в реакциях с металлами и водородом, но восстановителем в реакции с кислородом.
Вопросы, задания, задачи
1. Перечислите наиболее характерные степени окисления:
- а) кислорода;
- б) серы;
- в) селена.
Приведите примеры соответствующих соединений.
2. Назовите аллотропные модификации:
- а) кислорода;
- б) серы.
3. Составьте формулы оксидов и сульфидов лития, магния, алюминия.
4. Рассчитайте массу порции серы количеством 3,5 моль.
5. Заполните таблицу «Кислород и сера в окислительно-восстановительных реакциях», составив уравнения соответствующих реакций.
| Реагенты | Кислород | Сера |
| Н2 | ||
| Mg | ||
| Ca | ||
| Fe | ||
| Li | ||
| Na |
6. Составьте 10 уравнений возможных реакций между веществами, формулы которых Ba, K, Рt, ZnS, S, H2, O2. Укажите при этом степени окисления элементов.
7. Чему равен объём воздуха, необходимый для сжигания:
- а) серы массой 12 г;
- б) бутана объёмом 10 м3 (н. у.)?
8. Рассчитайте объём кислорода, который может быть получен при разложении бертолетовой соли массой 49 г.
9. Составьте уравнения реакций согласно схеме:
- a)
;
- б)
.
10. При нагревании перманганата калия массой 3,16 г получен кислород объёмом 168 см3 (н. у.). Определите массовую долю разложившейся соли.
*Самоконтроль
1. Низшая степень окисления атомов халькогенов равна:
- а) −4;
- б) −2;
- в) +4;
- г) +6.
2. Укажите выражения, характеризующие серу как простое вещество:
- а) при горении серы в кислороде возникает голубое пламя;
- б) на внешнем энергетическом уровне атома серы находится 6 электронов;
- в) сера используется для вулканизации каучука;
- г) сера входит в состав пирита и медного колчедана.
3. С кислородом могут реагировать:
- a) СuS;
- б) С2Н6;
- в) Cl2;
- г) H2.
4. К халькогенам относятся элементы с конфигурацией внешнего электронного слоя атома:
- а) ns2np2;
- б) 2s22p4;
- в) ns2np4;
- г) 4s24p4.
5. Число атомов в порции озона количеством 0,1 моль равно:
- а) 6,02 ∙ 10−22;
- б) 6,02 ∙ 1022;
- в) 1,204 ∙ 1023;
- г) 1,806 ∙ 1023.