§ 30. Галогены
Химические свойства

алюминия
с йодом
1. Реакции с металлами. Наиболее активным из галогенов является фтор. Уже при комнатной температуре он реагирует с большинством металлов:
Хлор при нагревании реагирует с серебром, золотом, платиной и другими металлами:
Для достижения заметной скорости реакции других галогенов с металлами обычно также требуется предварительное нагревание металла.
Обратим внимание на то, что простые вещества хлор и бром в силу высокой окислительной способности образуют c железом соединения ,
, в то время как действие соляной кислоты на железо приводит к образованию
.
2. Реакции с водородом:
- а) фтор взаимодействует при комнатной температуре:
;
- б) хлор реагирует при поджигании или воздействии ультрафиолетового излучения:
;
- в) бром реагирует при нагревании:
, реакция обратима;
- г) йод вступает в реакцию медленно даже при нагревании, реакция обратима:
.
Таким образом, реакционная способность по отношению к водороду снижается в ряду галогенов F2 — Cl2 — Br2 — I2.
3. Реакции с растворами солей галогеноводородных кислот. В водных растворах галогеноводородных кислот, а также их солей более электроотрицательный галоген вытесняет менее электроотрицательный. Так, хлор вытесняет бром и йод, например:
.
Бром вытесняет только йод из растворов йодидов:
.
Способность более активных галогенов вытеснять менее активные из их соединений используется на практике. Например, бром и йод получают при действии хлора на их соединения.
Для фтора реакция вытеснения из растворов менее активных галогенов не характерна, так как фтор вступает в реакцию с водой.
Фтор с водой реагирует, окисляя атомы кислорода в молекулах воды:
2F2 + 2H2O = 4HF + O2↑.
При растворении хлора в воде протекает обратимая реакция: . Образующийся раствор называют хлорной водой. Аналогично происходит растворение в воде брома и йода, но равновесные концентрации продуктов уменьшаются в ряду Cl2 — Br2 — I2.
4. Реакции с органическими веществами. Галогенирование органических соединений происходит чаще всего в реакциях замещения (насыщенные и ароматические углеводороды) или присоединения (ненасыщенные и ароматические углеводороды). Например:
- • хлорирование метана:
(реакция замещения);
- • бромирование бензола:
;
- • взаимодействие бромной воды с фенолом:
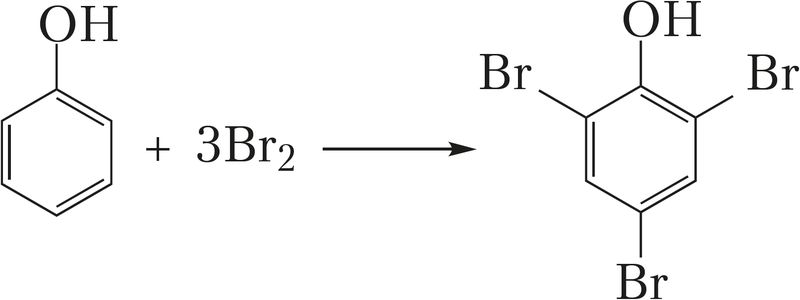 + 3HBr (реакция замещения);
+ 3HBr (реакция замещения);- • хлорирование этилена:
(реакция присоединения).
Из курсов биологии и органической химии вам также известно, что йод взаимодействует с раствором крахмала, образуя соединение синего цвета, а бромную воду используют как реагент на алкены, фенол, анилин.
5. Взаимодействие хлора со щелочами. В зависимости от условий проведения реакции образуются разные продукты. Так, при взаимодействии хлора с холодным раствором щёлочи хлор образует соли хлорид и гипохлорит:
а с горячим раствором — хлорид и хлорат:
Гипохлорит натрия широко применяется для дезинфекции сточных вод, воды в системах водоснабжения и плавательных бассейнов, в пищевой и целлюлозно-бумажной промышленности, медицине.
6. Особенности химических свойств фтора. Фтор, в отличие от других галогенов, которые не взаимодействуют с кислородом, реагирует с ним, однако процесс протекает только под действием электрического разряда при −196 °С:
В этом соединении атомы фтора имеют степень окисления −1, атомы кислорода как менее электроотрицательного элемента имеют положительную степень окисления +1. Поэтому O2F2 называют фторидом кислорода(I).
Вода при соприкосновении со фтором горит. Состав продуктов зависит от условий протекания реакции. Среди продуктов всегда обнаруживают фтороводород и кислород:
.
В атмосфере фтора окисляется даже платина: . Однако некоторые металлы (Mg, Al, Ni, Cu) устойчивы к действию фтора за счёт образования плотной плёнки фторида на поверхности металла.
Под давлением или при действии ультрафиолетового излучения фтор реагирует с криптоном и ксеноном с образованием фторидов благородных газов.